题目内容
16.某同学按如图所示的装置进行电解实验.下列说法中不正确的是( )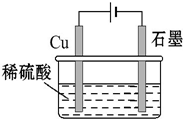
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主要反应方程式为:Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一段时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度不断减小 |
分析 根据图知,电解时,阳极上电极反应式为Cu-2e-=Cu2+、阴极上电极反应为2H++2e-=H2↑,当溶液中铜离子达到一定程度后,阴极上铜离子放电生成铜,据此分析解答.
解答 解:A.电解过程中,Cu作阳极,阳极上铜失电子发生氧化反应,所以铜逐渐溶解,故A错误;
B.电解初期,阳极上电极反应式为Cu-2e-=Cu2+、阴极上电极反应为2H++2e-=H2↑,所以电池反应式为Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑,故B正确;
C.电解一定时间后,溶液中铜离子达到一定程度后,石墨电极上铜离子放电生成铜,故C正确;
D.阳极上电极反应式为Cu-2e-=Cu2+、阴极上电极反应为2H++2e-=H2↑,溶液中氢离子浓度减小,故D正确;
故选A.
点评 本题考查了电解原理,知道阴阳极上发生的反应是解本题关键,注意活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.把Zn粒放入盛有稀盐酸的容器中,产生H2的速率与下列因素无关的是( )
| A. | 盐酸的浓度 | B. | 溶液的温度 | C. | Zn颗粒的大小 | D. | 溶液中Cl-的浓度 |
11.检验溶液中是否含有某种离子,下列操作方法正确的是( )
| A. | 加入AgNO3溶液,有白色沉淀生成,证明有Cl- | |
| B. | 用硝酸酸化后取上层清液,加入Ba(OH)2溶液,析出白色沉淀,证明有SO42- | |
| C. | 加浓NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,证明有NH4+ | |
| D. | 加入盐酸,放出能使澄清石灰水变浑浊的气体,证明含有CO32- |
1.如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知,过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将发生的现象是( )

| A. | U形管内红色褪去 | B. | 试管内溶液变红 | C. | 气球a被吹大 | D. | U形管水位d<c |
8.下列离子方程式正确的是( )
| A. | 足量的SO2通入氨水中:SO2+2NH3•H2O═2NH4++SO32-+H2O | |
| B. | SO2通入溴水中:Br2+SO2+2H2O═2H++SO42-+2HBr | |
| C. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 酸雨久置pH变小:2H2SO3+O2═4H++2SO42- |
5.在一定温度下,下列叙述中属于可逆反应A(g)+B(g)?2C(g)达到平衡标志的是( )
| A. | C的生成速率与C的分解速率相等 | |
| B. | 混合气体的压强不再变化 | |
| C. | 单位时间内消耗a mol A的同时消耗a mol B | |
| D. | A、B、C的物质的量之比为1:1:2 |
6.1.12克铁粉加入25mL 2mol/L的氯化铁溶液中,正确的是( )
| A. | 溶液中[Fe2+]<[Fe3+] | |
| B. | 溶液中[Fe2+]>[Fe3+] | |
| C. | 部分Fe3+被氧化 | |
| D. | 在反应后的溶液中加入KSCN溶液,会出现血红色沉淀 |
 目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2反应.
目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2反应. 实验室需要配制0.1mol/L NaOH溶液450mL,回答下列问题:
实验室需要配制0.1mol/L NaOH溶液450mL,回答下列问题: