题目内容
16.分析用石灰水保存鲜蛋的原理如下:(1)石灰水是碱性物质,能渗入蛋内和酸性物质反应,防止酸败;
(2)石灰水是电解质溶液,促使蛋白质凝聚;
(3)石灰水显弱碱性,有杀菌能力;
(4)石灰水能与鲜蛋呼出的CO2生成CaCO3薄膜,起保护作用.
其中正确的是( )
| A. | (1)(2) | B. | (1)(2)(3) | C. | (3)(4) | D. | (2)(3)(4) |
分析 鲜鸡蛋易变质是因为鲜鸡蛋里的细菌能通过鸡蛋壳上的空隙进行呼吸作用.鸡蛋在石灰水中,产生的二氧化碳与氢氧化钙反应,生成碳酸钙沉淀,将小空隙堵上,阻止细菌继续繁殖;同时石灰水具有碱性,杀菌能力强起到保鲜的作用进行分析.
解答 解:(1)石灰水能渗入蛋内中和酸性物质,也能导致蛋白质变性,故(1)错误;
(2)蛋白质凝聚说明蛋白质变性,故(2)正确;
(3)石灰水具有碱性,具有杀菌作用,故(3)正确;
(4)氢氧化钙和二氧化碳反应生成碳酸钙沉淀,将小空隙堵上,阻止细菌继续繁殖,故(4)正确.
所以(2)(3)(4)正确.
故选D.
点评 本题考查运用化学知识解决实际问题,难度较小,本题明白鸡蛋易变质的原因即可解答.

练习册系列答案
相关题目
6.根据热化学方程式:S(g)+O2(g)=SO2(g);△H=-a kJ•mol-1(a>0).下列说法正确的是( )
| A. | 1 mol SO2的总能量大于1 mol S和1 mol O2能量总和 | |
| B. | 1 mol SO2的总能量小于1 mol S和1 mol O2能量总和 | |
| C. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b小于a | |
| D. | S(s)+O2(g)=SO2(g)△H=-b kJ•mol-1,b大于a |
7.下列关于氧化还原反应说法正确的是( )
| A. | 一种元素被氧化,肯定有另外一种元素被还原 | |
| B. | 金属单质只有还原性,非金属单质只有氧化性 | |
| C. | 元素原子失电子数越多还原性越强,得电子数越多氧化性越强 | |
| D. | 有单质参加的化合反应和有单质生成的分解反应一定是氧化还原反应 |
4.在溶液导电性实验装置里,分别注入同体积同浓度的醋酸与氨水,灯光明暗程度相似.如果把这两种溶液混合后再实验,则( )
| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光变亮 | D. | 无法判断 |
11.为了维持生命和健康,人要从食物中摄取营养素,下列物质中不属于营养素的是( )
| A. | 葡萄糖 | B. | 食醋 | C. | 水 | D. | 芝麻油 |
1.下列物质中,在一定条件下既发生银镜反应,又能发生水解反应的是( )
| A. | 甲酸甲酯 | B. | 淀粉 | C. | 葡萄糖 | D. | 纤维素 |
4.若发现116号元素X,其最外层电子数为6,则下列叙述正确的是( )
| A. | X可以形成钠盐,其化学式为NaX | B. | X的最高价氧化物的水化物是强酸 | ||
| C. | X的最高价氧化物的化学式为XO3 | D. | X的单质能与H2直接发生化学反应 |
2.下列各项表述中与示意图一致的是( )

| A. | 图①表示第IA族元素原子半径的变化规律 | |
| B. | 图②表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,溶液中n(Mn2+) 随时间的变化 | |
| C. | 图③中a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0在使用和未使用催化剂时,反应过程中的能量变化 | |
| D. | 图④表示核外电子能量与电子层数的关系 |
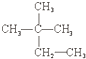 ③
③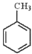 ④${\;}_{17}^{35}$Cl⑤
④${\;}_{17}^{35}$Cl⑤
 ⑧石墨 ⑨C2H4
⑧石墨 ⑨C2H4