题目内容
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)===ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)===2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)===[Cr(CH3COO)2]2·2H2O(s)
请回答下列问题:
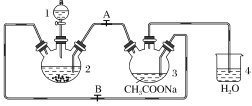
(1)仪器1的名称是________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是________(选下面字母);目的是__________________________________________________________________。
A、盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭止水夹________(填“A”或“B”,下同),打开止水夹________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是____________________________。(用离子方程式表示)
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51 g,取用的醋酸钠溶液为1.5 L 0.1 mol·L-1;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48 g,则该实验所得产品的产率为________(不考虑溶解的醋酸亚铬水合物)。
【答案】分液漏斗C让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化BA2Cr3++Zn==2Cr2++Zn2+ (使锌与CrCl3充分反应得到CrCl2)84.0%
【解析】
(1)根据仪器结构特征,可以知道仪器1为分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;
(4)过量的锌与CrCl3充分反应得到CrCl2;
(5) CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可以知道CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2·2H2O的理论产量,进而计算其产率。
(1)根据仪器结构特征,可以知道仪器1为分液漏斗,
因此,本题正确答案是:分液漏斗;
(2) 价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,
因此,本题正确答案是:C;让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;
(3) 利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,
因此,本题正确答案是:B;A;
(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2,离子方程式为:2Cr3++Zn==2Cr2++Zn2+ ,
因此,本题正确答案是:2Cr3++Zn==2Cr2++Zn2+ ;
(5) CrCl3为![]() =0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)===[Cr(CH3COO)2]2·2H2O(s)
=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)===[Cr(CH3COO)2]2·2H2O(s)
可以知道CH3COONa足量,则得到[Cr(CH3COO)2]2·2H2O为0.06mol ![]() 376g/mol=11.28g,
376g/mol=11.28g,
所得产品的产率为:![]() ×100%=84.0%,
×100%=84.0%,
因此,本题正确答案是:84.0%。