题目内容
16.FeCl3、CuCl2混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的( )| A. | 加入KSCN的溶液一定不变红色 | B. | 溶液中一定含有Fe3+ | ||
| C. | 溶液中可能含Cu2+ | D. | 剩余固体中一定有铜 |
分析 根据三价铁离子、铜离子的氧化性强弱判断反应先后顺序,从而确定固体的成分、溶液的成分;有固体剩余,若固体只有铜,则反应后的溶液中一定无三价铁离子存在,一定存在亚铁离子,可能含有铜离子;若有铁剩余,一定有铜生成,三价铁离子和铜离子无剩余,据此进行判断.
解答 解:①当固体为铁、铜时,溶液中的Fe3+、Cu2+全部参加反应生成Fe2+和Cu,反应的反应方程式为:2FeCl3+Fe=3FeCl2、CuCl2+Fe=Cu+FeCl2,所以溶液中一定没有Fe3+、Cu2+,一定含有Fe2+;
②当固体为铜时,溶液中一定没有Fe3+,Cu2+恰好全部参加反应或部分反应生成Fe2+和Cu,所以溶液中一定没有Fe3+,可能含有Cu2+,一定含有Fe2+;
A、溶液中一定不含Fe3+,所以加入KSCN溶液不变红色,故A正确;
B、通过以上分析知,溶液中一定不含有Fe3+,故B错误;
C、当固体为铜时,溶液中可能含有Cu2+,故C正确;
D、通过以上分析知,剩余固体中可能是Fe、Cu,还可以是Cu,剩余固体中一定有Cu.故D正确.
故选B.
点评 本题考查了离子的氧化能力大小的比较,能正确判断固体的成分是解本题的关键,根据固体的成分了解反应的先后顺序,从而确定溶液的成分.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
6.有机物M是苯的同系物,其结构为 ,则M可能的结构简式共有( )
,则M可能的结构简式共有( )
 ,则M可能的结构简式共有( )
,则M可能的结构简式共有( )| A. | 6种 | B. | 12种 | C. | 24种 | D. | 32种 |
7.下列描述的正确的是( )
| A. | Na2O2与水反应是水作还原剂的氧化还原反应 | |
| B. | 过氧化钠的电子式为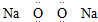 | |
| C. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA | |
| D. | 二氧化碳通过Na2O2粉末,反应后固体物质增重 |
4.下列行为中符合安全要求的是( )
| A. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,将水倒入浓硫酸中配制稀硫酸 | |
| D. | 进入煤矿井时,用火把照明 |
11.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.2NA | |
| B. | 常温常压下,1mol氦气所含原子数为2NA | |
| C. | 标准状况下,22.4L CCl4含有的氯原子数为4NA | |
| D. | 0.5mol•L-1 Na2CO3溶液中含有Na+离子的数目为NA |
1.下列变化过程,属于放热过程的是( )
| A. | 合成氨反应 | B. | 液态水变成水蒸气 | ||
| C. | 弱酸弱碱的电离 | D. | 灼热的炭与CO2的反应 |
5.某有机物链状分子中含n个-CH2-,m个 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )| A. | m+n+a | B. | m+2-a | C. | 2n+3m-a | D. | m+2n+2-a |
6.下列各组物质中,X是主体物质,Y是少量杂质,Z是除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | BaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |