题目内容
1.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g);
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L-2)为( )
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数K=c(NH3)•c(HI)计算.
解答 解:平衡时c(HI)=5mol•L-1,HI分解生成的H2的浓度为0.25mol•L-1,则:
NH4I分解生成的HI的浓度为5mol•L-1+2×0.25mol•L-1=5.5mol•L-1,
所以NH4I分解生成的NH3的浓度为5.5mol•L-1,
所以反应①的平衡常数k=c(NH3)•c(HI)=5.5mol•L-1×5mol•L-1=27.5mol2•L-2.
故选:D.
点评 本题考查化学平衡常数的计算,解题关键在于平衡时HI为NH4I分解生成的HI与分解的HI之差,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.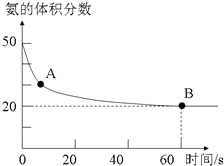 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素.在恒定温度下,混合气体中NH3的含量随时间的变化关系如图所示(该条件下尿素为固体).A点的正反应速率v正(CO2)大于B点的逆反应速率v逆(CO2)(填“大于”、“小于”或“等于”),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程中的中间产物.现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).实验测得在不同温度下的平衡数据如下表:
①上述反应的焓变:△H<0,熵变△S<0(填“>”、“<”或“=”).根据表中数据,列出15.0℃时该反应的化学平衡常数的计算式K=$\frac{1}{(1.6×1{0}^{-3})^{2}×(0.8×1{0}^{-3})}$(不要求计算结果).
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将不变(填“增大”、“减小”或“不变”).
(3)向含a mol NH4NO3的溶液中滴加b L氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将
逆向(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb=2×10-5)
 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素.在恒定温度下,混合气体中NH3的含量随时间的变化关系如图所示(该条件下尿素为固体).A点的正反应速率v正(CO2)大于B点的逆反应速率v逆(CO2)(填“大于”、“小于”或“等于”),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程中的中间产物.现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).实验测得在不同温度下的平衡数据如下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将不变(填“增大”、“减小”或“不变”).
(3)向含a mol NH4NO3的溶液中滴加b L氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将
逆向(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb=2×10-5)
9.某元素R的最高价氧化物对应的水化物是HnRO2n,则在气态氢化物中R元素的化合价是( )
| A. | 3n | B. | 3n-8 | C. | -3n | D. | 8-3n |
16.下列不属于消去反应的是( )
| A. | CH3CH2OH→CH2=CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH→CH3CH=CH2↑+NaBr+H2O | |
| C. |  CHClCH2Cl+2NaOH→ CHClCH2Cl+2NaOH→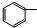 C≡CH+2NaCl+2H2O C≡CH+2NaCl+2H2O | |
| D. | 2CH3OH→CH3-O-CH3+H2O |
6.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再无机定性分析( )
| A. | Fe | B. | Si | C. | Cu | D. | Na |
13.锗(Ge)是第32号元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述中正确的是( )
| A. | 锗是一种金属性很强的元素 | B. | 锗化氢(GeH4)稳定性很强 | ||
| C. | 锗酸(H4GeO4)是难溶于水的强酸 | D. | 锗元素位于第四周期第ⅣA族 |
10.下列属于放热反应的是( )
| A. | 浓硫酸的稀释 | B. | 铝热反应 | ||
| C. | 氢气还原氧化铜 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 mol O2与Na完全反应,转移电子数一定为4NA | |
| B. | 常温常压下,1.7克NH3中含有共价键的数目为NA | |
| C. | 142g Na2SO4和Na2HPO4混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA |
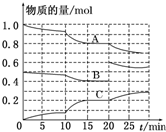 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题: