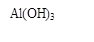题目内容
工业上用铝土矿(主要成分是Al2O3·H2O、Al2O3·3H2O以及少量Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取的操作过程可用以下流程图表示:
(1)写出滤液A中一种溶质与过量NaOH溶液反应进入滤液B中的离子方程式。
(2)若步骤①中没有过滤操作而直接进入步骤②,对后面操作将产生什么影响?
答案:
解析:
提示:
解析:
| (1)Al3++4OH-=AlO (2)①中的不溶物(SiO2)在操作②中会被氢氧化钠溶液溶解。
|
提示:
| 一种不溶于水的氧化物,要判别它属于哪一类氧化物,可根据各类氧化物的概念,用强酸和强碱溶液判别它,其原理为:若该氧化物只能溶于盐酸,则属于碱性氧化物;若该氧化物只能溶于NaOH溶液,则属于酸性氧化物;若该氧化物既能溶于盐酸又能溶于NaOH溶液,则属于两性氧化物。Al2O3为两性氧化物,能溶于盐酸和氢氧化钠;Fe2O3为碱性氧化物,溶于盐酸而不溶于氢氧化钠;SiO2为酸性氧化物,溶于氢氧化钠而不溶于盐酸。解答此题,关键要抓住这些氧化物性质的差异,形成分离、除杂质的思路。
|

练习册系列答案
相关题目