题目内容
【题目】有关下列图像的分析错误的是
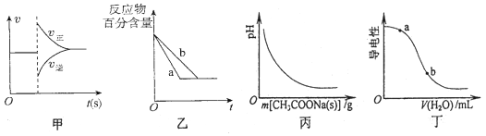
A.图甲可表示对平衡N2(g)+3H2(g)![]() 2NH3(g)加压、同时移除部分NH3时的速率变化
2NH3(g)加压、同时移除部分NH3时的速率变化
B.图乙中a、b曲线可表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程
C.图丙表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
D.图丁表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b
【答案】C
【解析】
试题分析:A、加压正逆反应速率同时增大,移除部分NH3时,逆反应速率减小,故正反应速率增大,逆反应速率减少,正确; B、图中a、b曲线可表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程,又因方程式左右两边气体系数相等,所以通过改变压强也可使反应物的百分含量相同,正确;C、向CH3COOH溶液中逐步加入CH3COONa固体,因为醋酸根离子浓度增大,所以醋酸的电离平衡逆向移动,pH增大,错误;D、醋酸的稀释过程中,氢离子浓度、醋酸根离子浓度均减小,导电性降低,pH增大,所以b>a,正确;故答案选B。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程,又因方程式左右两边气体系数相等,所以通过改变压强也可使反应物的百分含量相同,正确;C、向CH3COOH溶液中逐步加入CH3COONa固体,因为醋酸根离子浓度增大,所以醋酸的电离平衡逆向移动,pH增大,错误;D、醋酸的稀释过程中,氢离子浓度、醋酸根离子浓度均减小,导电性降低,pH增大,所以b>a,正确;故答案选B。

练习册系列答案
相关题目
【题目】80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4![]() 2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
2NO2 △H=+Q kJ·mol-1(Q>0),获得如下数据:下列判断正确的是
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
A. 升高温度该反应的平衡常数K减小
B. 20~40 s 内,v(N2O4)=0.002 mol/L .s
C. 反应达平衡时,吸收的热量为0.30 Q kJ/mol
D. 100s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率减小