题目内容
下列说法正确的是
| A.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 |
| B.等物质的量浓度的NaOH溶液与氨水中的c(OH-)相等 |
| C.含有相同氧原子数的SO2和CO的质量相等 |
| D.25℃和101kpa,1 mol CO的体积小于22.4L |
A
解析试题分析:A、甲基(-CH3)与羟基(-OH)含有的电子数分别均9个,因此等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等,A正确;B、氢氧化钠是强碱,完全电离。氨水是弱碱,部分电离,所以等物质的量浓度的NaOH溶液与氨水中的c(OH-)不相等,前者大,B不正确;C、含有相同氧原子数的SO2和CO的物质的量之比是1:2,所以质量之比是64:56=8:7,C不正确;D、常温常压下气体的摩尔体积是24.5L/mol,所以25℃和101kpa,1mol CO的体积大于22.4L,D不正确,答案选A。
考点:考查物质的量的有关计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列化学用语的表述正确的是
A.离子结构示意图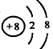 :可以表示16O2-,也可以表示18O2- :可以表示16O2-,也可以表示18O2- |
B.比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 |
C.氯化铵的电子式为: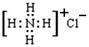 |
D.CO2的结构式为: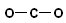 |
下列化学用语正确的是
A.中子数为20的氯原子: |
| B.硫酸的电离方程式:H2SO4=H2++SO42— |
| C.漂白粉的有效成分:CaCl2 |
| D.明矾的化学式:KAl(SO4)2?12H2O |
下列化学用语只能用来表示一种微粒的是
A. | B.2s22p6 | C.CH4O | D.C |
标准状况下,均含有NA个电子的H2O和NH3,具有相同的
| A.质量 | B.物质的量 | C.体积 | D.氢原子数 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.铁与足量稀硝酸反应,1mo1Fe失去电子数为3nA |
| B.常温常压下,22.4L乙烯中含极性共价键数目为5nA |
| C.1L1mol?L—1的NH4Cl溶液中有nA个NH4+ |
| D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下充分反应生成H2O个数为nA |
有关四氯化碳的化学用语正确的是
A.结构简式: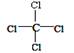 | B.电子式: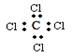 |
| C.结构简式:CCl4 | D.比例模型:  |
在V mL Al2(SO4)3溶液中含有Al3+m g,取V/4 mL该溶液用水稀释至4V mL,则SO42-物质的量浓度为
A. mol/L mol/L | B. mol/L mol/L | C. mol/L mol/L | D. mol/L mol/L |
若NA表示阿伏加德罗常数,下列说法正确的是
| A.1 mol Na2O2与水反应时,转移电子的数目为2 NA |
| B.标准状况下,22.4 L水中含有水分子的数目为NA |
| C.14 g N2中含有电子的数目为7 NA |
| D.数目为NA的一氧化碳分子和0.5 mol甲烷的质量比为7︰4 |