题目内容
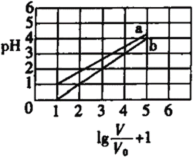
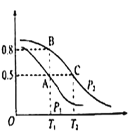
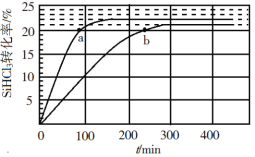
【题目】反应 2SiHCl3(g)![]() SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
下列说法不正确的是
A.343 K 时反应物的平衡转化率为 22%
B.a、b 处反应速率大小:va>vb
C.要提高 SiHCl3 转化率,可采取的措施是降温和及时移去反应产物
D.已知反应速率![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时 ![]()
【答案】C
【解析】
由图示,温度越高反应速率越快,达到平衡用得时间就越少,所以曲线a代表343K的反应,曲线b代表323K的反应;要提高反应物的转化率,就需要使平衡向右移动,从此角度出发进行分析;根据转化率列出三段式,再利用达到平衡时正反应速率等于逆反应速率,进行相关的计算。
A.由图示,温度越高反应速率越快,达到平衡用得时间就越少,所以曲线a代表343K的反应,从图中读出343 K 时反应物的平衡转化率为 22%,A正确;
B.a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即va>vb,B正确;
C.由图可知,温度越高转化率越大,减少生成物,根据勒夏特列原理,平衡正向移动,则转化率增大,所以要提高SiHCl3转化率,可采取的措施是升温和及时移去反应产物,C错误;
D.假设开始时SiHCl3的物质的量浓度为cmol/L,343 K 时反应物的平衡转化率为 22%,则有:
![]() ,
,![]() ,
,![]()
已知反应速率![]() ,平衡时v正=v逆,则有
,平衡时v正=v逆,则有![]() ,所以
,所以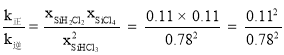 ,D正确。
,D正确。
答案选C。

【题目】25 ℃下,部分弱酸的电离常数如表。下列有关说法正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡 常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A.相同浓度的HCOOH和HClO溶液的pH后者小
B.若HCOONa和HCOOH的混合溶液的pH=3,则![]() =10
=10
C.任何浓度NaHS溶液中总存在:c(Na+)+c(H+)=c(OH-)+c(HS-)
D.向NaClO溶液中通入H2S发生的反应为2ClO-+H2S===S2-+2HClO