题目内容
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )
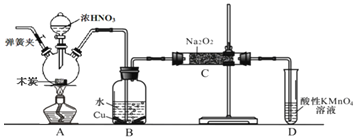
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
【答案】D
【解析】
装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮、二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜、一氧化氮和水;最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气;
A.若将B中药品换成NaOH溶液,二氧化氮与氢氧化钠反应,没有NO放出,故A错误;
B.因为一氧化氮中混有二氧化碳和水蒸气,二氧化碳和过氧化钠发生反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠和氧气,在B、C装置间增加一个盛放无水![]() 的干燥管,只能除去NO中的水,无法除去二氧化碳,故B错误;
的干燥管,只能除去NO中的水,无法除去二氧化碳,故B错误;
C.由于实验过程中有一氧化氮产生,所以要将装置中的空气全部排尽,再进行实验,实验结束时应先熄灭酒精灯,再停止通入![]() ,可以防止倒吸等意外事故的发生,故C错误;
,可以防止倒吸等意外事故的发生,故C错误;
D.酸性条件下,NO能与![]() 反应生成
反应生成![]() 和
和![]() ,D装置用于尾气处理,标况下,
,D装置用于尾气处理,标况下,![]() LNO的物质的量等于
LNO的物质的量等于![]() mol,根据得失电子守恒,消耗的高锰酸钾为
mol,根据得失电子守恒,消耗的高锰酸钾为![]() mol,故D正确;
mol,故D正确;
答案选D。

练习册系列答案
相关题目






