题目内容
14.工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法.下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
(1)写出下列化学方程式:
a.乙炔水化法制乙醛CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO.
b.乙烯氧化法制乙醛2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO.
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法,分析可能的原因(从环境、原料来源、能耗等角度分析,任写一点):两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等.
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?乙烯氧化法快.
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法,理由是因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济.
(5)如果某工厂以乙烯为原料,通过3步可以制得聚氯乙烯,请写出合理的反应方程式(无机试剂和溶剂等任选,改过程中不发生取代反应)
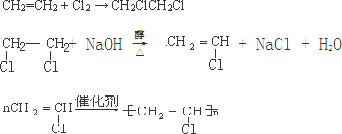 .
.
分析 (1)乙炔水化法是乙炔和水加成反应得到制乙醛,乙烯氧化法是乙烯被催化氧化生成制乙醛;
(2)对比“乙烯氧化法”、“乙炔水化法”两种方法,从化学反应速率、日产量、消耗的催化剂的性质以及能源的消耗角度来回答;
(3)从表一来看,两者反应条件温度相当,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
从表二来看,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得;
(4)依据转化率,增大压强消耗能源,增大投入等因素分析;
(5)以乙烯为原料,通过3步可以制得聚氯乙烯,方案为乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中发生消去反应得到氯乙烯,在引发剂作用下发生聚合反应生成聚乙烯.
解答 解:(1)乙炔水化法是乙炔和水加成反应得到制乙醛,反应的化学方程式为:CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO,
乙烯氧化法是乙烯被催化氧化生成制乙醛,反应的化学方程式为:2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO,
故答案为:CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO,2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO;
(2)对比“乙烯氧化法”、“乙炔水化法”两种方法,从环境保护和能耗角度可以知道,两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,从产率和产量角度可以看出:虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,
对比“乙烯氧化法”、“乙炔水化法”两种方法,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等,
故答案为:两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等;
(3)从表一来看,两者反应条件温度相当,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
从表二来看,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,较难获得;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得,所以从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法中乙烯氧化法快,
故答案为:乙烯氧化法快;
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法是因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济,
故答案为:因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济;
(5)以乙烯为原料,通过3步可以制得聚氯乙烯,方案为乙烯和氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷在氢氧化钠溶液中发生消去反应得到氯乙烯,在引发剂作用下发生聚合反应生成聚乙烯,反应的化学方程式为: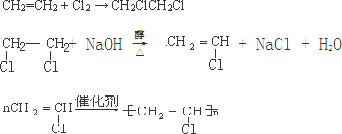 ,
,
故答案为: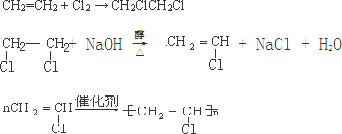 .
.
点评 本题考查有机物的合成及计算,注意表格数据的分析和物质的合成的关系,能利用数据和流程分析判断是解题关键,对学生能力的考查较高,题目难度中等.

| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
| A. | 0~1min,CO的平均反应速率为o.5mol/(L•min) | |
| B. | 增大压强,化学反应速率加快,K增大 | |
| C. | H2S的平衡转化率为71.4% | |
| D. | 平衡后,又加入CO、H2各1mol,平衡逆动 |
已知

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①如图1导管B除了导气外还具有的作用是冷凝.
②加热试管A采用热水浴,而非直接加热.目的是控制温度85℃左右,防止环己醇挥发,使受热均匀,试管C置于冰水浴中的目的是防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.
加入饱和食盐水,振荡、静置、分层,环己烯在上层 层(填“上”或“下”),分液后用c(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填字母).
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c.
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)制环己烯时,由于浓硫酸的强氧化性,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是④⑤①⑤②③(或④⑤①⑤③②)(填序号)①%2和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水④无水CuSO4 ⑤品红溶液.

| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中.
步骤2:充分反应后,向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.

(1)步骤1仪器a中发生的主要化学反应方程式为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
(2)仪器c的作用是冷凝回流,回流的主要物质有:C6H6、Br2.
(3)步骤3中NaOH所发生的主要反应是:Br2+2NaOH=NaBr+NaBrO+H2O.
(4)若将图1虚线框部分改为图2装置,则 D、E可以检验出来的物质是HBr,其中试管C中苯的作用是吸收溴蒸气,能否据此判断发生了取代反应?是(填“是”或“否”).
| A. | 甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 甲苯与浓硫酸和浓硝酸混酸反应生成2,4,6-三硝基甲苯 | |
| C. | 1mol甲苯能与3mol氢气发生加成反应 | |
| D. | 甲苯可以燃烧并产生浓烈的黑烟 |



