题目内容
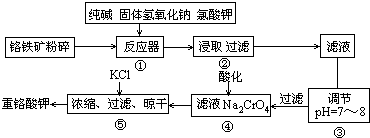
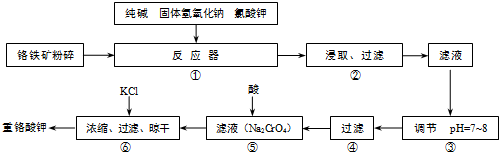
铬铁矿的主要成分为FeO· CrO3,另外还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(
K2Cr2O7)的过程如下图所示。
K2Cr2O7)的过程如下图所示。
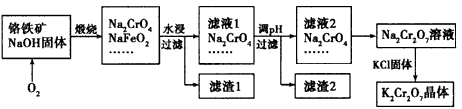
已知:①NaFeO2遇水强烈水解。
②Cr2O72- + H2O 2CrO42- +2H+。
2CrO42- +2H+。
请回答:
(1) K2Cr2O7中Cr元素的化合价是_____________。
(2)生成滤渣1中红褐色物质的反应的化学方程式是___________ 。滤液1的成分除Na2CrO4外,还含有(填化学式)_____________。
(3)利用滤渣2可制得两种氧化物,其中一种氧化物经电解冶炼 可获得金属,该电解反应的化学方程式是 ________________。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是_________________。
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、__________ 、过滤、洗涤、干燥。
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2的化学方程式是_______________。
②Cr2O72- + H2O
 2CrO42- +2H+。
2CrO42- +2H+。请回答:
(1) K2Cr2O7中Cr元素的化合价是_____________。
(2)生成滤渣1中红褐色物质的反应的化学方程式是___________ 。滤液1的成分除Na2CrO4外,还含有(填化学式)_____________。
(3)利用滤渣2可制得两种氧化物,其中一种氧化物经电解冶炼 可获得金属,该电解反应的化学方程式是 ________________。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是_________________。
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、__________ 、过滤、洗涤、干燥。
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2的化学方程式是_______________。
(1)+6
(2) NaFeO2 + 2H2O == NaOH + Fe(OH)3 ;NaAlO2 ,Na2SiO3和 NaOH
(3)2 Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
(4)加硫酸酸化
(5)冷却结晶
(6) 4FeO·Cr2O3 + 7O2 + 20NaOH 8Na2CrO4 + 4NaFeO2 +10H2O
8Na2CrO4 + 4NaFeO2 +10H2O
(2) NaFeO2 + 2H2O == NaOH + Fe(OH)3 ;NaAlO2 ,Na2SiO3和 NaOH
(3)2 Al2O3(熔融)
 4Al+3O2↑
4Al+3O2↑(4)加硫酸酸化
(5)冷却结晶
(6) 4FeO·Cr2O3 + 7O2 + 20NaOH
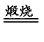 8Na2CrO4 + 4NaFeO2 +10H2O
8Na2CrO4 + 4NaFeO2 +10H2O 
练习册系列答案
相关题目