题目内容
(2013?漳州二模)关于下列各实验装置的叙述中,不正确的是( )


分析:A、装置①为萃取、分液,可用于分离两种互不相容的两种液体;
B、装置②从a管进入气体,可收集密度比空气小的气体,从b管进入可收集密度比空气大的气体;
C、装置③可以吸收易溶于水的气体,并可防倒吸;
D、装置④可收集能用碱石灰干燥、密度比空气小且易溶于水的气体.
B、装置②从a管进入气体,可收集密度比空气小的气体,从b管进入可收集密度比空气大的气体;
C、装置③可以吸收易溶于水的气体,并可防倒吸;
D、装置④可收集能用碱石灰干燥、密度比空气小且易溶于水的气体.
解答:解:A、装置①萃取、分液,可用于分离两种互不相容的两种液体,而C2H5OH和H2O能以任意比互溶,不能装置①分离,可以用蒸馏的方法分离,故A错误;
B、装置②若从a管进入气体,可收集密度比空气小的气体,如氢气、氨气等;从b管进入可收集密度比空气大的气体,如二氧化碳、氯气、氯化氢、二氧化氮等,故B正确;
C、装置③X若为CCl4,NH3或HCl极易溶于水且不溶于CCl4的气体,可以用装置③并可防倒吸,故C正确;
D、氨气为碱性气体可用碱石灰干燥,氨气密度比空气小极易溶于水,可用向上排空气法收集,用一倒置的漏斗防倒吸并吸收多余的氨气,所以装置④可干燥、收集NH3,并吸收多余的NH3,故D正确.
故选A.
B、装置②若从a管进入气体,可收集密度比空气小的气体,如氢气、氨气等;从b管进入可收集密度比空气大的气体,如二氧化碳、氯气、氯化氢、二氧化氮等,故B正确;
C、装置③X若为CCl4,NH3或HCl极易溶于水且不溶于CCl4的气体,可以用装置③并可防倒吸,故C正确;
D、氨气为碱性气体可用碱石灰干燥,氨气密度比空气小极易溶于水,可用向上排空气法收集,用一倒置的漏斗防倒吸并吸收多余的氨气,所以装置④可干燥、收集NH3,并吸收多余的NH3,故D正确.
故选A.
点评:本题考查了常见的实验操作,完成此题,可以依据已有的知识进行,要求同学们加强对基础知识的储备,以便灵活应用.

练习册系列答案
相关题目

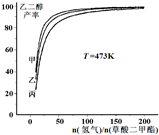 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=


