题目内容
(2009?金华模拟)将4.96g某铜银合金溶于10mL13.0mol/L的浓硝酸中,待合金完全溶解后,收集到气体896mL(标准状况),并测得溶液的c(H+)=3mol/L.假设反应所得气体只可能是NO2、NO或它们的混合物,反应后溶液的体积仍为10mL.试计算:
(1)被还原硝酸的物质的量.
(2)合金中银的质量分数.
(3)所得气体的组成(若为混合物,需算出各组成成分的体积).
(1)被还原硝酸的物质的量.
(2)合金中银的质量分数.
(3)所得气体的组成(若为混合物,需算出各组成成分的体积).
分析:被还原的硝酸的物质的量等于生成气体的物质的量,根据反应中消耗硝酸的物质的量结合质量守恒列方程组可计算合金中银的质量分数,最后利用电子守恒来确定混合气体中的成分.
解答:解:(1)被还原的硝酸的物质的量等于生成气体的物质的量,即:n(HNO3)(被还原)=
=0.04mol,
答:被还原的硝酸的物质的量为0.04mol;
(2)剩余硝酸的物质的量为n(HNO3)(剩余)=0.01L×3mol/L=0.03mol,
参加反应的硝酸为:0.01L×13.0mol/L-0.03mol=0.1mol,
由质量和N元素守恒可知,
解得x=0.04mol,y=0.01mol,
则合金中银的质量分数为
×100%=87.1%,
答:合金中银的质量分数为87.1%;
(3)设NO2、NO的物质的量分别为m、n,
由电子守恒可知,m+3n=0.04mol+0.01mol×2,
由N原子守恒可知,m+n=0.04,
联立两式可解得m=0.03mol,n=0.01mol,
即V(NO)=224mL,V(NO2)=672mL,
答:混合气体中含有224mLNO,672mLNO2.
| 0.896L |
| 22.4L/mol |
答:被还原的硝酸的物质的量为0.04mol;
(2)剩余硝酸的物质的量为n(HNO3)(剩余)=0.01L×3mol/L=0.03mol,
参加反应的硝酸为:0.01L×13.0mol/L-0.03mol=0.1mol,
由质量和N元素守恒可知,
|
解得x=0.04mol,y=0.01mol,
则合金中银的质量分数为
| 108g/mol×0.04mol |
| 4.96g |
答:合金中银的质量分数为87.1%;
(3)设NO2、NO的物质的量分别为m、n,
由电子守恒可知,m+3n=0.04mol+0.01mol×2,
由N原子守恒可知,m+n=0.04,
联立两式可解得m=0.03mol,n=0.01mol,
即V(NO)=224mL,V(NO2)=672mL,
答:混合气体中含有224mLNO,672mLNO2.
点评:本题考查方程式的相关计算,可从质量守恒的角度计算,可以省去书写化学方程式的繁琐.

练习册系列答案
相关题目
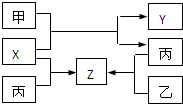 (2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系:
(2009?金华模拟)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物.它们之间有如下转化关系: