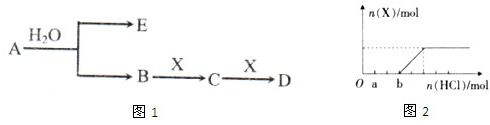题目内容
14.在一定条件下,向体积为2L的密闭容器中加入2mol N2和10mol H2发生如下反应:N2+3H2?2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是( )| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.0125 mol•L-1•s-1 | ||
| C. | v(NH3)=1.0 mol•L-1•min-1 | D. | v(H2)=0.75 mol•L-1•min-1 |
分析 根据v=$\frac{△c}{△t}$计算v(N2),再利用速率之比等于化学计量数之比计算v(H2)、v(NH3),据此判断.
解答 解:在一定条件下,向1L密闭容器中加入2mol N2和10molH2,发生反应N2+3H2?2NH3,2分钟末时,测得剩余氮气为1mol,故2min内,以 N2表示的反应速率v(N2)=$\frac{2mol-1mol}{2L×2min}$=0.25 mol/(L•min),
A.由上述计算可知,v(N2)=0.25 mol/(L•min),故A正确;
B.速率之比等于化学计量数之比,故υ(H2)=3v(N2)=3×0.25 mol/(L•min)=0.75 mol/(L•min)=0.0125 mol•L-1•s-1,故B正确;
C.速率之比等于化学计量数之比,故υ(NH3)=2v(N2)=2×0.25 mol/(L•min)=0.5mol/(L•min),故C错误;
D、由上述计算可知,v(H2)=0.75 mol/(L•min),故D正确;
故选C.
点评 本题考查化学反应速率的计算,比较基础,常用计算方法有定义法与化学计量数法,根据情况选择合适的计算方法.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
4.用试纸检验气体性质是一种重要的实验方法,如下表所示的实验中(可加热),下列试纸的选用、现象及对应结论均正确的一项是( )
| 选项 | 试剂 | 湿润的试纸 | 现象 | 结论 |
| A | Na2SO3,浓硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| D | Cu,浓硝酸 | 淀粉-KI试纸 | 变蓝 | NO2为酸性气体 |
| A. | A | B. | B | C. | C | D. | D |
5.过氧化钠可作为氧气的来源.常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
| 二氧化碳 | 碳酸钠 | 转移的电子 | |
| A | 1mol | NA | |
| B | 22.4L | 1mol | |
| C | 212g | 1mol | |
| D | 106g | 2NA |
| A. | A | B. | B | C. | C | D. | D |
2.萜类物质中有许多都已被用于香料工业.常见的有如下几种结构(括号内表示④的结构简式),关于上述四种香料,下列说法正确的是( )
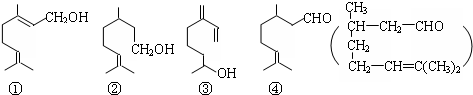

| A. | ④是②的氧化产物 | B. | ①③互为同系物 | ||
| C. | ②③均属于烯烃 | D. | ③④均能发生消去、酯化反应 |
9.常温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
3.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. |  2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
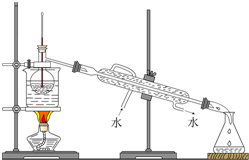 按要求写出下列化学方程式:
按要求写出下列化学方程式: .
.