题目内容
 将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )
将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )
A.AB段发生反应的的离子方程式为:
Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O
B.D点表示的溶液呈酸性
C.C点表示的沉淀的化学式为Al(OH)3、BaSO4、Fe(OH)2
D.混合物中FeSO4和AlCl3的物质的量相等
C
解析:
三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间,FeSO4+Ba(OH)2=BaSO4↓+Fe(OH)2↓,4Fe(OH)2+2H2O+O2=4Fe(OH)3,Al3+可与OH-反应,则C点沉淀的化学式为Al(OH)3、BaSO4、Fe(OH)3。
根据图象知,未加H2SO4前,n[Fe(OH)3]=n(BaSO4)=0.01mol,共0.02mol,此时Al3+变为AlO2-,可知n(FeSO4)=0.01mol;又由最终沉淀0.05mol知:n[Ba(OH)2]=0.05mol。
A→B:Ba2++SO42-=BaSO4↓,OH-+H+=H2O
 由C→E共消耗30mLH2SO4,而0.01molFe(OH)3消耗15mLH2SO4,可知Al(OH)3消耗15mLH2SO4,判定n[Al(OH)3]=n[Fe(OH)3]=0.01mol,可知:n(AlCl3)=0.01mol。综上分析,A、B、D均正确。
由C→E共消耗30mLH2SO4,而0.01molFe(OH)3消耗15mLH2SO4,可知Al(OH)3消耗15mLH2SO4,判定n[Al(OH)3]=n[Fe(OH)3]=0.01mol,可知:n(AlCl3)=0.01mol。综上分析,A、B、D均正确。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 (2010?湖北模拟)将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示.下列有关判断不正确的是( )
(2010?湖北模拟)将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示.下列有关判断不正确的是( )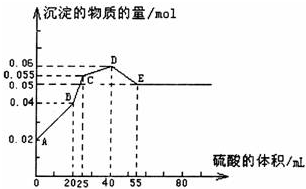

 将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )
将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )