题目内容
(11分)Ⅰ.下表为元素周期表的一部分:
族 周期 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
用化学用语回答下列问题:
(1)写出元素④在周期表中的位置____________________。
(2)②、③、⑤的原子半径由大到小的顺序为____________________。
(3)②与⑤元素氢化物的沸点由高到低_____________________。
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:____________________。
Ⅱ.已知下图是常见元素形成的单质或化合物A、B、C、D、E、X转化关系(部分生成物和反应条件略去)

(1)若E为氧化物
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为 。
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为 。
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 。
(11分)(除注明外,每空2分)Ⅰ.(1)第三周期第IVA族 (2)Na>S>O (1分)
(3)H2O>H2S (1分) (4)NaOH 或NaClO(1分)
Ⅱ.(1) ① CO32―+H2O  HCO3― + OH― ② Fe + 4H+ +NO3―= Fe3+ + NO↑+2H2O
HCO3― + OH― ② Fe + 4H+ +NO3―= Fe3+ + NO↑+2H2O
(2)Na 、Na2O2 或NaH(选其中之一即可)
【解析】
试题分析:根据元素再周期表中的相对位置可知①~⑥分别是H、O、Na、Si、S、Cl。
(1)元素④是Si,原子序数是14,在周期表中的位置是第三周期第IVA族。
(2)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则②、③、⑤的原子半径由大到小的顺序为Na>S>O。
(3)水分子间存在氢键,所以②与⑤元素氢化物的沸点由高到低为H2O>H2S。
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,该化合物可以是NaOH 或NaClO。
Ⅱ.(1)①若E为氧化物,当X是碱性盐溶液,C分子中有22个电子时,则C是CO2,所以A是NO2、B是硝酸、E是NO、X是碳酸盐、D是碳酸氢盐,则表示X呈碱性的离子方程式为CO32―+H2O  HCO3― + OH―。
HCO3― + OH―。
② 当X为金属单质时,这说明X是具有多种化合价的铁元素,则X与B的稀溶液反应生成C的离子反应方程式为Fe + 4H+ +NO3―= Fe3+ + NO↑+2H2O。
(2)若E为单质气体,D为白色沉淀,则X是铝盐,C是偏铝酸盐,D是氢氧化铝,B是氢氧化钠,则A的化学式可能是Na 、Na2O2 或NaH。
考点:考查元素推断以及无机框图题推断

 名校课堂系列答案
名校课堂系列答案
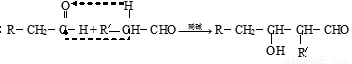

 和
和 的有关比较正确的是
的有关比较正确的是