题目内容
物质结构决定性质,下列叙述正确的是
- A.离子化合物熔沸点较高、共价化合物熔沸点较低
- B.非金属原子间不可能形成离子化合物
- C.确定某化合物为离子化合物,可以用融化时能否导电来判断
- D.共价化合物中可能有离子键
A、共价化合物形成离子晶体,熔沸点会大于离子晶体;
B、错,比如NH4Cl;
C、离子化合物在液体中可以电离,而共价化合物不能电离;
D、只有全部是共价键的才是共价化合物。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)下列4种物质熔点沸点由高到低排列为______________(填序号)
①金刚石(C—C) ②晶体硅(Si—Si) ③金刚砂(Si—C)
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个
顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(3)按所示格式填写下表有序号的表格:
| 原子序数 | 原子价层电子排布 | 周期 | 族 |
| 17 | ① | 第三 | ② |
| ③ | 3d54s1 | ④ | ⅥB |
(4)某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)下列4种物质熔点沸点由高到低排列为______________(填序号)
①金刚石(C—C) ②晶体硅(Si—Si) ③金刚砂(Si—C)
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个
顶点,该晶体中 X、Y、Z的粒子个数比为______________;

(3)按所示格式填写下表有序号的表格:
|
原子序数 |
原子价层电子排布 |
周期 |
族 |
|
17 |
① |
第三 |
② |
|
③ |
3d54s1 |
④ |
ⅥB |
(4)某元素的激发态原子的电子排布式为1s2s2p3s3p4s,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A通常显 ▲ 价,A的电负性 ▲ B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。组成蛋白质的最简单的氨基酸中的碳原子杂化态是 ▲ 。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
 (3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图1所示),其中3种离子晶体的晶格能数据如下表:
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图1所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该 4种离子晶体熔点从高到低的顺序是: ▲ 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的
Mg2+有 ▲ 个。
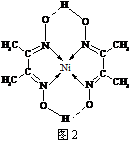 (4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(5)某配合物的分子结构如右图2所示,其分子内不含有
▲ (填序号)。
A. 离子键 B. 极性键 C. 金属键
D. 配位键 E. 氢 键 F. 非极性键
 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.
 2s
2s 3s
3s 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 。