题目内容
13.通常把铝粉与某些金属氧化物的混合物称为铝热剂,下列氧化物中不能与铝粉发生铝热反应的是( )| A. | V2O5 | B. | Cr2O3 | C. | MnO2 | D. | Na2O |
分析 铝热反应的实质为金属单质之间的置换反应,能跟铝粉组成铝热剂的金属氧化物对应的金属活泼性应比Al的弱,据此进行解答.
解答 解:由金属活泼性可知,只有Na的金属性大于Al,而V2O5、Cr2O3、MnO2中金属的活泼性均小于Al,只有D不能与铝粉发生铝热反应,
不能与铝粉发生铝热反应的是Na2O,
故选D.
点评 本题Al的性质及铝热反应,为高频考点,把握金属的活泼性为解答的关键,注意铝热反应的特点及金属冶炼原理,题目难度不大.

练习册系列答案
相关题目
3.主族元素R最高价氧化物对应水化物的化学式为H2RO3,则其氢化物的化学式是( )
| A. | HR | B. | RH3 | C. | H2R | D. | RH4 |
4.下列物质在一定条件下不能发生消去反应的是( )
| A. | (CH3)2CHCH2OH | B. | CH3CH2OH | C. | CH3CH2I | D. | CH3Cl |
1.下列关于铁和铝的性质叙述错误的是( )
| A. | 补血剂中含有+2价铁元素 | |
| B. | 铁粉和氧化铝的混合物叫铝热剂,反应时放出大量热 | |
| C. | 铝是人体中的一种微量元素,如果摄入量过多,易患老年痴呆症 | |
| D. | 铝的金属活动性比铁的金属活动性强 |
8.下列说法中错误的是( )
| A. | 位于 IA的元素与位于ⅦA的元素组成的化合物都是离子化合物 | |
| B. | 元素周期表中ⅡA族的元素都是金属元素 | |
| C. | 元素周期表有7个横行,18个纵列 | |
| D. | 除氦外的稀有气体原子的最外层电子数都是8个 |
18.下列仪器中不属于计量仪器的是( )
| A. | 量筒 | B. | 滴定管 | C. | 温度计 | D. | 烧杯 |
5.发展绿色食品,避免“白色污染”,增强环保意识,是保护环境,提高人类生存质量的重要措施.“白色污染”是指( )
| A. | 白色建筑废料 | |
| B. | 聚乙烯等白色塑料垃圾 | |
| C. | 石灰窑的白色粉末 | |
| D. | 经济附加值高的营养食品和冶炼厂的白色烟尘 |
2.下列有关实验装置或实验操作正确的是( )
| A. | 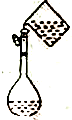 配置一定物质的量浓度的溶液 | B. | 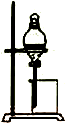 用CCl2萃取碘水中的溴 | ||
| C. | 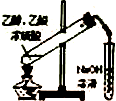 制备乙酸乙酯 | D. | 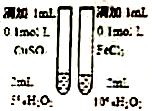 比较不同催化剂对反应速率的影响 |
7.已知:相关物质的溶度积常数见表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反
应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.