题目内容
已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是
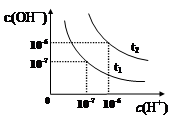
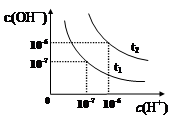
| A.t1<t2 |
| B.一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化 |
| C.t2温度pH值为2的HCl溶液中,水电离出的c(H+)=1×10-10mol·L-1 |
| D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小 |
D
试题分析:A、根据图像可知,温度t1和t2时水的离子积常数分别是1.0×10-14、1.0×10-12。电离吸热加热促进电离,离子积常数增大,所以t1<t2,A正确;B、水的离子积常数只与温度有关系,温度不变,水的离子积常数不变,因此一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化,B正确;C、t2温度pH值为2的HCl溶液中,氢离子浓度是0.01mol/L。而离子积常数是1.0×10-12,所以溶液中OH-浓度是1×10-10mol/L。则根据水的电离方程式H2O
 H++OH-可知,水电离出的c(H+)=c(OH-)=1×10-10mol/L,C正确;D、将t1温度下0.1 mol·L-1的盐酸稀释,溶液中氢离子和氯离子浓度均减小,但根据离子积常数表达式KW=c(H+)·c(OH-)可知,溶液中c(OH-)增大,D不正确,答案选D。
H++OH-可知,水电离出的c(H+)=c(OH-)=1×10-10mol/L,C正确;D、将t1温度下0.1 mol·L-1的盐酸稀释,溶液中氢离子和氯离子浓度均减小,但根据离子积常数表达式KW=c(H+)·c(OH-)可知,溶液中c(OH-)增大,D不正确,答案选D。
练习册系列答案
相关题目
 mol/L
mol/L