题目内容
下列各组实验现象可用同一原理解释的是
| A.品红溶液中分别通入SO2和Cl2,品红均褪色 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低 |
| C.溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
| D.鸡蛋白溶液中分别加入NaCl溶液和CuCl2溶液,均有固体析出 |
C
解析试题分析:A、氯气与水反应生成次氯酸,具有强氧化性,使品红褪色,不能复原,SO2与品红发生化合使品红褪色,加热能复原,二者褪色原理不同,错误;B、浓硫酸具有吸水性,盐酸易挥发,二者浓度都降低,但原理不同,错误;C、植物油和裂化汽油中都含有双键,可以发生加成反应使溴水褪色,正确;D、因浓的无机盐溶液能使蛋白质发生盐析产生沉淀,如饱和硫酸钠溶液、氯化钠溶液、硫酸铵溶液;而重金属盐能使蛋白质发生变性而产生沉淀,如氯化铜、HgCl2等,错误。
考点:本题考查物质的性质及应用。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别可以是
| | 干燥气体a | 液体b |
| A | NO2 | 水 |
| B | C12 | 饱和食盐水 |
| C | NH3 | 水 |
| D | CO2 | 4 mol·L—1NaOH溶液 |
根据下列实验现象,所得结论正确的是( )
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>Ⅰ2 |
| C | 左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 | 氧化性:Cl2>Br2>S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |
下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
| 物质编号 | 物质转化关系 | A | D | E |
| ① | 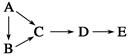 | Si | SiO2 | Na2SiO3 |
| ② | S | SO3 | H2SO4 | |
| ③ | Na | Na2O2 | NaOH | |
| ④ | N2 | NO2 | HNO3 |
下列各组物质不能实现直接转化的是
| A.S→SO2→H2SO4→MgSO4 | B.Cu→CuCl2→Cu(NO3)2→Cu(OH)2 |
| C.Al→Al2O3→Al(OH)3→NaAlO2 | D.Na→Na2O→Na2CO3→NaCl |
中学化学中很多“规律”都可以类推,下列根据有关“规律”推出的结论正确的是( )
| A.CO2为直线形分子,故CS2也为直线形分子 |
| B.浓硫酸可以干燥HCl气体,故也可用浓硫酸干燥HI气体 |
| C.Na在空气中燃烧会生成Na2O2,故Li在空气中燃烧也会生成Li2O2 |
| D.卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高 |
下表所列各组物质中,不能通过一步反应实现如图所示转化的是
| 物质 选项 | a | b | c |
| A | Si | Na2SiO3 | SiO2 |
| B | Fe | FeCl3 | FeCl2 |
| C | AlCl3 | Al(OH)3 | NaAlO2 |
| D | Na2O2 | Na2CO3 | NaOH |
下列叙述错误的是
| A.Al2(SO4)3可除去酸性废水中的悬浮颗粒 |
| B.氯气与石灰乳反应能得到含氯漂白剂 |
| C.燃煤时加入适量石灰石,可减少废气中SO2的排放 |
| D.工业上硝酸可用于制化肥、农药、炸药和染料等 |