题目内容
工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)若某制革厂含硫废水中主要含有的物质是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因: .
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4.则反应中还原剂与氧化剂的物质的量之比为 .
(2)若含硫废水中主要含有的物质为Na2SO3,回收废水中含硫的化合物,以减少资源的浪费,可采用以下方法:
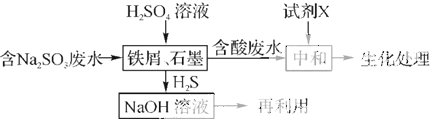
①中和含酸废水时工业中常用的试剂X是 .
②写出H2S气体与足量NaOH溶液反应的化学方程式: .
(1)若某制革厂含硫废水中主要含有的物质是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因:
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4.则反应中还原剂与氧化剂的物质的量之比为
(2)若含硫废水中主要含有的物质为Na2SO3,回收废水中含硫的化合物,以减少资源的浪费,可采用以下方法:

①中和含酸废水时工业中常用的试剂X是
②写出H2S气体与足量NaOH溶液反应的化学方程式:
考点:含硫物质的性质及综合应用,氧化还原反应的计算,盐类水解的应用,物质的分离、提纯和除杂
专题:氧族元素
分析:(1)①Na2S为强碱弱酸盐,S2-水解呈碱性;
②根据氧化还原反应中氧化剂和还原剂得失电子数目相等计算;
(2)①中和含酸废水工业中常用廉价的石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水.
②根据氧化还原反应中氧化剂和还原剂得失电子数目相等计算;
(2)①中和含酸废水工业中常用廉价的石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水.
解答:
解:(1)①Na2S为强碱弱酸盐,S2-水解呈碱性,水解方程式为S2-+H2O HS-+OH-;
HS-+OH-;
故答案为:S2-+H2O HS-+OH-;
HS-+OH-;
②1molNa2S转化为1molNa2SO4,失去8mol电子,而1molO2被还原,得到4mol电子,所以还原剂与氧化剂的物质的量之比为1:2;
故答案为:1:2;
(2)①中和含酸废水工业中常用廉价的石灰水;
故答案为:石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水,反应的化学方程式为H2S+2NaOH=Na2S+2H2O.
故答案为:H2S+2NaOH=Na2S+2H2O.
 HS-+OH-;
HS-+OH-;故答案为:S2-+H2O
 HS-+OH-;
HS-+OH-;②1molNa2S转化为1molNa2SO4,失去8mol电子,而1molO2被还原,得到4mol电子,所以还原剂与氧化剂的物质的量之比为1:2;
故答案为:1:2;
(2)①中和含酸废水工业中常用廉价的石灰水;
故答案为:石灰水;
②H2S气体与足量NaOH溶液反应反应生成Na2S和水,反应的化学方程式为H2S+2NaOH=Na2S+2H2O.
故答案为:H2S+2NaOH=Na2S+2H2O.
点评:本题考查较内容难度不大,涉及氧化还原反应、中和反应等问题,本题注意把握氧化还原反应的计算问题即可,本题难度不大.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
常温下,向体积为1 0mL、物质的量浓度均为0.1mol/L的盐酸和醋酸的混合溶液中滴入0.1mol/L NaOH溶液.下列说法错误的是( )
| A、加入NaOH溶液后,溶液一定满足:c(H+)+c(Na+)═c(OH-)+c(C1-)+c(CH3COO-) |
| B、加入10 mLNaOH溶液时,溶液满足(溶液体积变化忽略不计):c(CH3COO-)+c(CH3COOH)=0.05 mol/L |
| C、加入15 mLNaOH溶液时,呈酸性,溶液满足:c(Na+)>c(C1-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D、加入足量NaOH溶液时,溶液中发生的中和反应的热化学方程式表示为:H+(aq)+OH-(aq)═H2O(1)△H=一57.3 kJ?mol-1 |
二氧化硅属于酸性氧化物的理由主要是( )
| A、硅是非金属元素 |
| B、二氧化硅对应的水化物是可溶性弱酸 |
| C、二氧化硅能和强碱反应生成盐和水 |
| D、二氧化硅不能与酸反应 |
在实验室中,对下列事故或药品的处理正确的是( )
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、酒精灯打翻着火,用水灭火 |
| D、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
在一定温度下,可逆反应N2(g)+3H2(g)
2NH3(g)达到平衡的标志是( )
| 催化剂 |
| 高温高压 |
| A、NH3的生成速率与H2的生成速率相等 |
| B、单位时间内生成n mol N2同时生成3n mol H2 |
| C、N2、H2、NH3浓度不再变化 |
| D、N2、H2、NH3分子数之比为1:3:2 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、加入苯酚显紫色的溶液;K+、NH+4、Cl-、I- |
| B、pH=12的溶液:Na+、Ca2+、HCO-3、Cl- |
| C、水电离出的c(H+)=10-12mo1?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、0.1 mol?L-1的Cu(NO3)2溶液:Na+、K+、S2-、SO2-4- |
能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( )
| A、苯 | B、乙烯 | C、甲烷 | D、乙烷 |
下列描述,其因果关系成立的是( )
| A、因为NH3的水溶液可以导电,所以NH3是电解质 |
| B、因为SO2可以使溴水褪色,所以SO2具有漂白性 |
| C、因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH |
| D、因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应 |
 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答: