题目内容
在101kPa和25°C时,有关反应的热化学方程式如下:
C(s)+1/2 O2(g)=CO(g) △H1= -110.5KJ/mol
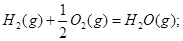
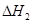 =
=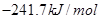
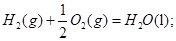
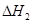 =
=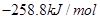
下列说法正确的是( )
A.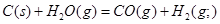 ;
;
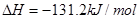
B.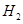 燃烧热的化学方程式为:
燃烧热的化学方程式为: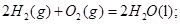
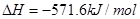
C.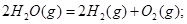
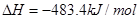
D.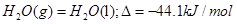
【答案】
D
【解析】根据盖斯定律可知,①-②即得到 ,所以该反应的反应热△H=-110.5KJ/mol+241.7kJ/mol=+134.2kJ/mol,选项A不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确;水分解是吸热反应,△H大于0,选项C不正确;根据盖斯定律可知,选项D正确,因此正确的答案选D。
,所以该反应的反应热△H=-110.5KJ/mol+241.7kJ/mol=+134.2kJ/mol,选项A不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以选项B不正确;水分解是吸热反应,△H大于0,选项C不正确;根据盖斯定律可知,选项D正确,因此正确的答案选D。

练习册系列答案
相关题目
在101kPa和25℃时,有关反应的热化学方程式如下:
C(s)+
O2(g)=CO(g)△H1=-111kJ?mol-1
H2(g)+
O2(g)=H2O(g)△H2=-242kJ?mol-1
C(s)+O2(g)=CO2(g)△H3=-394kJ?mol-1
在同条件下,CO(g)+H2O(g)=H2(g)+CO2(g)△H,则△H是( )
C(s)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
C(s)+O2(g)=CO2(g)△H3=-394kJ?mol-1
在同条件下,CO(g)+H2O(g)=H2(g)+CO2(g)△H,则△H是( )
| A、-41kJ?mol-1 |
| B、+41kJ?mol-1 |
| C、-152kJ?mol-1 |
| D、-263kJ?mol-1 |