题目内容
【题目】一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol/L,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.75 mol/L,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol/L,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.75 mol/L,则下列叙述正确的是
A.平衡向逆反应方向移动B.x+y<z
C.B的物质的量浓度减小D.C的体积分数增大
【答案】D
【解析】
保持温度不变,将容器的容积压缩为原来的一半,若平衡不移动,A气体的浓度为1 mol/L,实际A的浓度变为0.75 mol/L,说明增大压强,化学平衡向正方向移动,据此结合选项解答。
保持温度不变,将容器的容积压缩为原来的一半,如平衡不移动,A气体的浓度为1 mol/L,实际A的浓度变为0.75 mol/L,说明平衡向正方向移动。
A. 保持温度不变,将容器的容积压缩为原来的一半,如平衡不移动,A气体的浓度为1 mol/L,实际A的浓度变为0.75 mol/L,说明平衡向正方向移动,A错误;
B. 体积减小即增大压强,化学平衡向正方向移动,根据平衡移动原理,增大压强,化学平衡向气体体积减小的方向移动,则x+y>z,B错误;
C. 增大压强,平衡向正反应方向移动,使B的物质的量减小,平衡移动的趋势是微弱的,但是密闭容器的容积压缩为原来的一半,B的物质的量浓度仍然增大,C错误;
D. 增大压强,化学平衡向正反应方向移动,C的体积分数增大,D正确;
故合理选项是D。

【题目】下表给出了五种元素的相关信息,其中![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素。
为短周期元素。
元素 | 相关信息 |
| 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| 工业上通过分离液态空气获得它的一种单质,含它的另一种单质的浓度相对较高的平流层是保护地球地表环境的重要屏障 |
| 植物生长所需的主要元素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| 室温下其单质为粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| 它是人体不可缺少的微量元素,含该元素的合金是工业生产中不可缺少的金属材料,常用于建造桥梁、楼房等 |
根据上述信息填空:
(1)![]() 元素的原子含有________个能层,其中第二能层中的能级包括_________;画出
元素的原子含有________个能层,其中第二能层中的能级包括_________;画出![]() 的原子结构示意图:________________。
的原子结构示意图:________________。
(2)![]() 与
与![]() 形成的某种化合物能和
形成的某种化合物能和![]() 与
与![]() 形成的另一种无色化合物(这两种化合物分子中
形成的另一种无色化合物(这两种化合物分子中![]() 与另一元素原子的个数比均为
与另一元素原子的个数比均为![]() )一起用作火箭推进剂,写出二者发生反应生成无毒物质的化学方程式:__________________________________。
)一起用作火箭推进剂,写出二者发生反应生成无毒物质的化学方程式:__________________________________。
(3)某矿藏主要含![]() 、
、![]() 两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出生产该强酸过程中第一阶段主要反应的化学方程式:________。
两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出生产该强酸过程中第一阶段主要反应的化学方程式:________。
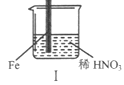
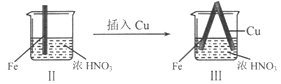
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化