题目内容
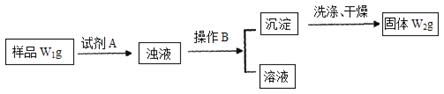
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下: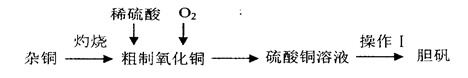
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
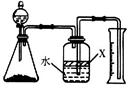
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。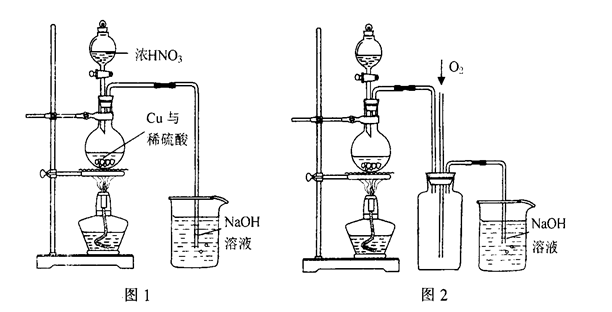
烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
(16分)(1)蒸发浓缩(2分);冷却结晶(2分) (2)ab(2分,选对1个1分,有错误不得分)
(3)CuO(2分,其它合理答案也可) Fe(OH)3(2分)
(4)Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(2分,写对1个即得2分) ①防止NaOH溶液倒吸进入发生装置(2分) ②NO、NO2有毒气体能被完全吸收(2分)
解析试题分析:(1)硫酸铜能溶于水,所以从硫酸铜溶液中得到硫酸铜晶体得操作应该是蒸发浓缩、冷却结晶,然后过滤烘干即可。
(2)灼烧后的产物除氧化铜还含少量铜,这说明a.灼烧过程中部分氧化铜被还原,a正确;b.灼烧不充分.铜未被完全氧化,b正确;c.氧化铜稳定,在加热过程中不可能分解生成铜,c不正确;d.铜极易被氧化生成氧化铜,d不正确,答案选ab。
(3)由于反应中不能再引入新的杂质,所以要调节溶液的pH小于进入氧化铜或氢氧化铜。由于氢氧化铁沉淀的pH小于氢氧化铜沉淀的pH,所以首先生成氢氧化铁沉淀,过滤得硫酸铜溶液。
(4)硝酸具有强氧化性,能把铜氧化生成硝酸铜,但随着反应的进行,硝酸浓度逐渐降低,其还原产物将逐渐变为NO,因此有关反应的化学方程式是Cu+4H++2NO3-=Cu2++2H2O+2NO2↑、3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。由于NO2与氢氧化钠溶液反应时,溶液容易倒吸,且NO与氢氧化钠溶液不反应,易造成环境污染,所以图2中通入氧气可以氧化NO而不完全吸收,即装置2的优点是①防止NaOH溶液倒吸进入发生装置;②NO、NO2有毒气体能被完全吸收。
考点:考查物质的分离与提纯;氧化还原反应的有关判断与应用;硝酸性质;实验条件的控制以及实验方案设计与评价等

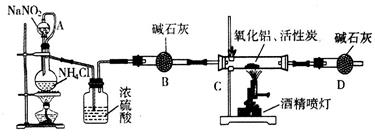
氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。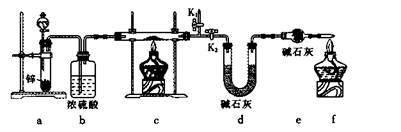
(4)装置a中所加的酸是____________(填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
| A.反应前后装置a的质量 |
| B.装置c充分反应后所得固体的质量 |
| C.反应前后装置d的质量 |
| D.反应前后装置e的质量 |
方案2:将实验l所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量(资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否巳完全干燥的操作方法是__________________________________。
(8)若实验所得不溶物为ng,则该样品中氧化亚铜的质量分数为________________。
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是:
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
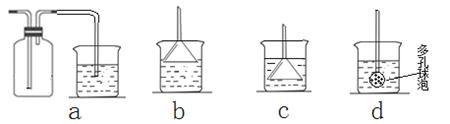
根据下列实验现象,所得结论正确的是( )

| 实验 | 实验现象 | 结论 |
| A | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 金属活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |

 N2O3(g),其平衡常数表达式为K = 。
N2O3(g),其平衡常数表达式为K = 。

 。
。