题目内容
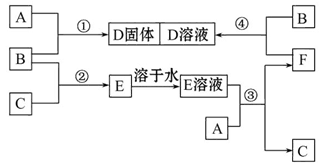
某工厂排放的工业废水中含Fe3+、A13+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了铁红、A12O3和金属Cu。
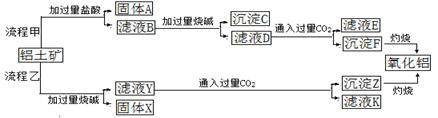
(1)固体A的成分是 。
(2)写出B→D的离子方程式 。
(3)溶液E焰色反应呈黄色,试剂H是 (填化学式)。
(4)写出D→F反应的离子方程式 。
(5)分别写出铁红和氧化铝在工业上的一种主要用途:铁红 ,氧化铝 。
(6)将溶液E转化为A12O3,请设计一个最合理的方案 (用文字表述)。
(1)Fe、Cu(共2分:答对1个给1分,答错一个不给分)
(2)2Fe2++Cl2=2Fe3++2Cl-(共2分)
(3)NaOH(共1分)
(4)Fe3++3OH-=Fe(OH)3↓(共2分)
(5)用作红色油漆和涂料 制造耐火坩埚等(共2分,答案合理即给分)
(6)在溶液E中通入过量的CO2,经过滤和洗涤后,加热固体即得Al2O3。(共1分;答到“加酸”给0.5分,答到“加热固体”给0.5分)
解析试题分析:(1)Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu,由于铁屑过量,则固体A由Fe、Cu组成;B溶液所含金属阳离子为Fe2+、A13+,固体C为目标产物之一的Cu;G为稀硫酸或稀盐酸;(2)氯水是强氧化剂,将Fe2+氧化为Fe3+,即2Fe2++Cl2=2Fe3++2Cl-;D溶液所含金属阳离子为Fe3+、A13+;(3)由目标产物逆推,E为NaAlO2溶液,F为Fe(OH)3,则H为NaOH;(4)Fe3+与OH—反应生成Fe(OH)3沉淀,即Fe3++3OH-=Fe(OH)3↓;(5)铁红常用作炼铁原料、红色油漆和涂料,氧化铝常用作炼铝原料、制造耐火坩埚等;(6)先将AlO2-转化为Al(OH)3沉淀,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或3AlO2-+Al3++6H2O=4Al(OH)3↓;再过滤、洗涤,最后灼烧滤渣,使Al(OH)3分解生成Al2O3和H2O。
考点:考查钠铝铁铜等金属元素及其化合物、混合物的分离和提纯实验等相关知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
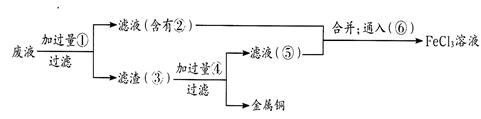
小学生10分钟应用题系列答案工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: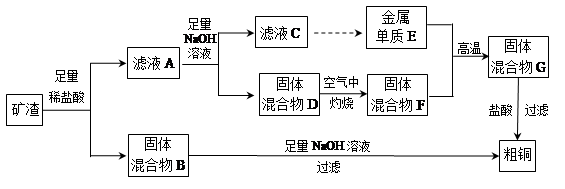
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物B与氢氧化钠溶液反应的化学方程式为 。
(2)滤液A中铁元素的存在形式只能为Fe2+,理由是
。涉及的离子方程式为 、
(不必书写Cu2O与盐酸的反应)。检验滤液A中Fe2+的试剂为 (填试剂名称)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用的最佳试剂为 __ (填序号)。
| A.氢氧化钠溶液 | B.硫酸溶液 | C.氨水 | D.二氧化碳 |
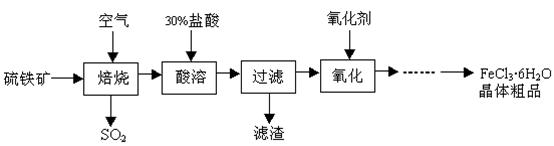
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: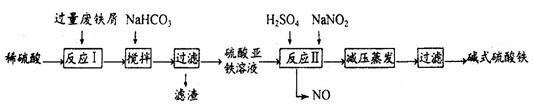
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)反应I溶液中存在的金属阳离子有__________________。
(2)加入NaHCO3的目的是调节pH,使溶液中的______(填“Fe3+”、“Fe2+”或“A13+”)沉淀。该工艺流程中“搅拌”的作用是_____________。
(3)反应II的离子方程式为__________。在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为________。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为__________。
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为__________________________。
甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3【可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水】。
(1)请完成下表:
| | 甲同学 | 乙同学 |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | | |
| 化学方程式 | | A12(SO4)3+6NH3·H2O=2A1(OH)3 ↓+3(NH4)2SO4 |
| 离子方程式 | | |
(2)若是你来制取Al(OH)3,试剂组合还可以是 。
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明) 。