题目内容
主族元素R的最高价氧化物0.112 g,溶于水制得100 g碱性溶液,其溶质的质量分数为0.148%,R原子核内含有20个中子.试通过计算,确定R元素在周期中的位置.
答案:
解析:
解析:
|
答案:第4周期第ⅡA族 解析:本题的解题思路是设法求出R的相对原子质量.在大多数情况下,相对原子质量近似等于其质量数,将质量数减去中子数就可求得核电荷数,从而确定元素名称.但根据本题所给条件,通过计算得出相对原子质量是不可行,因为计算中有两个未知数,一是相对原子质量A,一是元素的化合价x,只能列出一个方程.最后根据A与x的关系式,通过讨论法求解. 设R的相对原子质量为A,化合价为+x. (1)当x=1时,A=20,则原子核内不含质子,这是不可能的. (2)当x=2时,A=40,40-20=20,20号元素为Ca. (3)当x=3时,A=60,则质子数为40.在已知元素中除 |

练习册系列答案
相关题目
某主族元素R的最高价氧化物含氧酸的分子式为 ,则在气态氢化物中R元素的化合价为
,则在气态氢化物中R元素的化合价为
[ ]
|
A.-10+3n |
B.-6+3n |
|
C.-4+2n |
D.-12+3n |
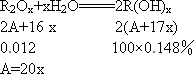
 .该元素组成的以下物质,其分子式肯定错误的是( )
.该元素组成的以下物质,其分子式肯定错误的是( ) .该元素组成的以下物质,其分子式肯定错误的是( )
.该元素组成的以下物质,其分子式肯定错误的是( ) .该元素组成的以下物质,其分子式肯定错误的是( )
.该元素组成的以下物质,其分子式肯定错误的是( ) 表示。该元素组成的以下物质,其分子式肯定错误的是
表示。该元素组成的以下物质,其分子式肯定错误的是