题目内容
14.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为23.下列说法正确的是( )| X | Y | ||
| Z | W | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 含Z元素的弱酸不能与含W元素的弱酸反应得到强酸 | |
| D. | T元素形成的酸与W元素形成的酸相比,酸性一定后者弱 |
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令X的最外层电子数为a,则Y、Z、W、T最外层电子数分别为a+2、a+2、a+3,故a+a+2+a+2+a+3=23,解得a=4,故X为C,Y为O,Z为S,W为Cl,T为Br,据此解答.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令X的最外层电子数为a,则Y、Z、W、T最外层电子数分别为a+2、a+2、a+3,故a+a+2+a+2+a+3=23,解得a=4,故X为C,Y为O,Z为S,W为Cl,T为Br,
A.X、Y、Z三种元素最低价氢化物分别为甲烷、水、硫化氢,常温下水为液态,甲烷、硫化氢为气体,故水的沸点最高,故A错误;
B.C、O和H形成的化合物中有共价键,故B正确;
C.Z的弱酸亚硫酸与W的弱酸次氯酸反应生成盐酸和硫酸,即能得到强酸,故C错误;
D.高氯酸的酸性强于高溴酸,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意A中氢键对物质性质的影响,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9. 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )
 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
10.下列说法不正确的是( )
| A. | 2015年3月5日,李克强总理在政府工作报告中说:“生态环保贵在行动、成在坚持,要求全年能耗强度下降3.1%以上”,从源头上消除污染,这符合“绿色化学”的理念 | |
| B. | 农业废弃物、水生植物、油料植物、城市与工业有机废弃物、动物粪便等均蕴藏着丰富的生物质能 | |
| C. | 硅藻泥材料具有很好的吸音降噪、净化空气、防霉防潮等性能,已成为当下时兴的环保装修材料,硅藻泥主要原材料为硅藻上,成分是SiO2,拥有多空的结构,具有强吸附性 | |
| D. | 把粉末状的氢化钛泡沫剂添加到熔融的金属铝中,冷却后可得到某种金属泡沫,利用该金属泡沫具有强度低、质量轻等特性可用于建造海上漂浮城市. |
2.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2:既有Zn又有Cu.
(4)请你设计实验验证上述假设1,完成下表内容.
(1)上述实验中发生反应的离子方程式有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2:既有Zn又有Cu.
(4)请你设计实验验证上述假设1,完成下表内容.
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
9.下列说法不正确的是( )
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
6.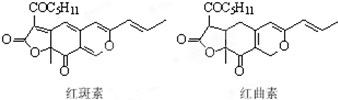 着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
 着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )
着色剂为使食品着色的物质,可增加对食品的嗜好及刺激食欲.红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示.下列说法正确的是( )| A. | 红斑素和红曲素互为同分异构体 | |
| B. | 一定条件下红斑素和红曲素都能发生加聚和缩聚反应 | |
| C. | 红斑素中含有醚键、羰基、酯键这三种含氧官能团 | |
| D. | 1 mol红曲素最多能与6 mol H2发生加成反应 |
3.离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝.下列电解原理正确的是( )
| A. | 钢制品应接电源的正极 | |
| B. | 电镀时铝作阳极,阳极反应式为Al-3e-+7AlCl4-=4Al2Cl7- | |
| C. | 电解液中H+移向阴极,OH-移向阳极 | |
| D. | 每生成1mol铝,电解液中转移3mol电子 |
 ;
;
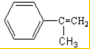
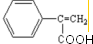
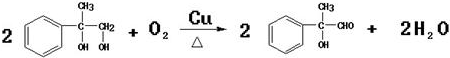 ;反应⑦n
;反应⑦n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$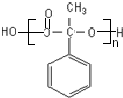 +(n-1)H2O
+(n-1)H2O