题目内容
6.高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO.下列选项中,一定符合反应达到化学平衡时情况的选项是bca、压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大
b、速率关系:2v正(CO2)=v逆(CO)
c、转移电子数随温度升高而增多
d、气体密度随着焦炭的增加而增大.
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:a、对于反应C+CO2=2CO,压缩体积,CO的浓度增大的倍数一直比CO2的浓度增大的倍数大,不能判断平衡,故a错误;
b、化学平衡时速率之比等于物质的量之比,由2v正(CO2)=v逆(CO)可知,同种正逆反应速率相同,为平衡状态,故b正确;
c、温度升高平衡正向移动,消耗焦炭的量增加,所以转移电子数增多,达到平衡时转移电子数不再变化,故c正确;
d、焦炭的是增加,平衡不移动,气体的物质的量不变,体积固定,所以密度是个定值,故d错误;
故选:bc.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
12.将下列离子方程式改写成化学方程式,正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═H2O+CO2↑ BaCO3+2HCl═BaCl2+H2O+CO2↑ | |
| C. | Ca2++CO32-═CaCO3↓ Ca(OH)2+K2CO3═CaCO3↓+2KOH | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
13.氨基呈碱性,氨基酸呈两性,把甘氨酸(氨基乙酸)放入一定pH的溶液中,所得溶液中不能同时大量存在的微粒是( )
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
11.下列分子式只能表示一种物质的是( )
| A. | C3H7Cl | B. | CH2Cl2 | C. | C4H10 | D. | C2H6O |
18.标准状况下,气态分子断开1mol化学键所需的能量称为键能.已知H-H,H-O,和O═O键的键能分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
15.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向苯酚的浓溶液中加入溴水,无沉淀产生 | 苯酚与溴水不反应 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去 | 使溶液褪色的气体只是乙烯 |
| D | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
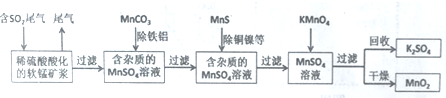
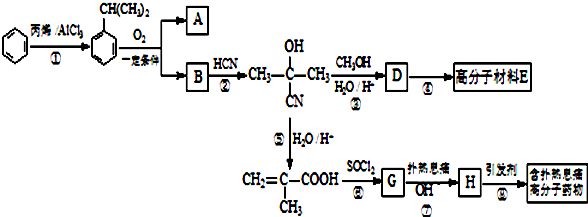

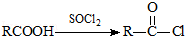
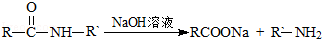
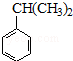 可转化为1mol A和1molB,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式:
可转化为1mol A和1molB,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式: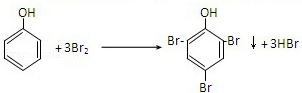 ;
;  ;扑热息痛的结构简式为
;扑热息痛的结构简式为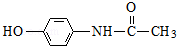 .
.