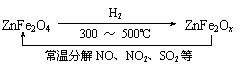题目内容
大气中污染气体之一SO2,可用如下方法测定其含量,将含有SO2的空气通过酸化KMnO4溶液,使SO2氧化为SO![]() 。现有500L空气,其密度为1.2g•L-1。通过KMnO4溶液后有1.50×10-5mol KMnO4被还原为Mn2+。配平该反应的离子方程式并计算空气中SO2的质量百分含量。
。现有500L空气,其密度为1.2g•L-1。通过KMnO4溶液后有1.50×10-5mol KMnO4被还原为Mn2+。配平该反应的离子方程式并计算空气中SO2的质量百分含量。
□MnO![]() +□
+□![]() +□ ==
□Mn2++□SO
+□ ==
□Mn2++□SO![]() +□H+
+□H+
答案:
解析:
提示:
解析:
2MnO 关系式 2MnO 2 5×64 1.5×10-5 mol x g ∴ x=2.4×10-3g 空气中
|
提示:
题中指出是酸化的KMnO4溶液,同时生成物中又出现了H+,则反应物中空格应当是H2O。配平后,依关系式求得结果。
|

练习册系列答案
相关题目






 CO2(g)
+ H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将
移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如图t2后所示的变化,则改变的条件可能是 (填符号)。
CO2(g)
+ H2(g),反应过程中各物质的浓度如右图t1前所示变化。若保持温度不变,t2时再向容器中充入CO、H2各1mol,平衡将
移动(填“向左”、 “向右”或“不”)。t2时,若改变反应条件,导致H2浓度发生如图t2后所示的变化,则改变的条件可能是 (填符号)。


 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol