题目内容
18.下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是( )| A. | 乙酸乙酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液 | |
| B. | 乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液 | |
| C. | 乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 苯中含苯酚杂质:加入浓溴水,过滤 |
分析 A.乙酸与碳酸钠反应后,与乙酸乙酯分层;
B.乙酸与碳酸钠反应后,与乙醇互溶;
C.乙酸与NaOH反应后,与乙醛互溶;
D.溴、三溴苯酚均易溶于苯.
解答 解:A.乙酸与碳酸钠反应后,与乙酸乙酯分层,然后分液可除杂,故A正确;
B.乙酸与碳酸钠反应后,与乙醇互溶,不能分液,应选蒸馏法,故B错误;
C.乙酸与NaOH反应后,与乙醛互溶,不能分液,应选蒸馏法,故C错误;
D.溴、三溴苯酚均易溶于苯,引入新杂质,不能除杂,应选NaOH溶液、分液,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握有机物的性质、性质差异及混合物分离方法的选择为解答本题关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
8.由2-氯丙烷制取少量的1,2-二氯丙烷时,需要经过下列哪几步反应( )
| A. | 加成→消去 | B. | 加成→水解 | C. | 消去→加成 | D. | 消去→取代 |
6.同温、同压下,体积相同的甲醛(CH2O)和一氧化氮(NO)两种气体.下列有关两气体的说法中不正确的是( )
| A. | 所含分子数相等 | B. | 分子间的平均距离相等 | ||
| C. | 分子中的电子总数相等 | D. | 氧原子数相等 |
13.下列说法正确的是( )
| A. | Na2O2、NaClO中所含化学键类型完全相同 | |
| B. | 只有活泼金属与活泼非金属元素之间才能形成离子键 | |
| C. | D2O和T2O是同一物质 | |
| D. | 氯气与NaOH反应的过程中,同时又离子键、极性键和非极性键的断裂和形成 |
3.25℃的下列溶液中,碱性最强的是( )
| A. | 1L中含有4 g NaOH的溶液 | |
| B. | 稀释1mL,1mol/L NaOH溶液到1L后所得溶液 | |
| C. | pH=11的溶液 | |
| D. | 0.11 mol/LNaOH溶液跟等体积0.05mol/L H2SO4溶液的混合液 |
10.下列反应中,属于取代反应的是( )
①H2C═CH2+Br2$→_{△}^{Cu或Ag}$ BrH2C-CH2Br
②2CH3CH2OH+O2$→_{△}^{浓H_{2}SO_{4}}$2CH3CHO+2H2O
③CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O
④
①H2C═CH2+Br2$→_{△}^{Cu或Ag}$ BrH2C-CH2Br
②2CH3CH2OH+O2$→_{△}^{浓H_{2}SO_{4}}$2CH3CHO+2H2O
③CH3COOH+CH3CH2OH?CH3COOCH2CH3+H2O
④

| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
7.下列各组物质中,所含分子数相同的是( )
| A. | 10gH2和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.5molBr2 | D. | 22.4mLH2(标准状况)和0.1molN2 |
 ;
; 其单体的键线式
其单体的键线式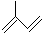 ;
; 的名称(系统命名法)3,3,4-三甲基已烷.
的名称(系统命名法)3,3,4-三甲基已烷.