题目内容
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态砷原子的价电子排布式为____。
(2)氟、氧、砷三种元素的电负性由大到小的顺序是____(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反:Fe(SCN)3+6NH4F=== (NH4)3FeF6+3NH4SCN
①NH4F 中阳离子的立体构型为____。
②(NH4)3FeF6存在的微粒间作用力有__(选填序号,下同)。
a.离子键 b.共价键 c.金属键 d.配位键 e.范德华力 f.氢键
③已知SCN中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为____,该原子团中σ与π键个数比为____。
(4)FeCl3晶体易溶于水、乙醇,受热易气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:____。
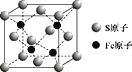
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为 ___。设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)____cm。
【答案】4S24P3 F>O>As 正四面体 abd sp 1:1 FeF3为离子晶体,FeCl3为分子晶体 FeS ![]()
【解析】
(1)主族元素基态原子的价层电子排布就是最外层电子排布,所以基态砷原子的价层电子排布式为4s24p3,故答案为:4s24p3;
(2)非金属性越强,电负性越大,所以氟、氧、砷三种元素电负性值由大到小的顺序是F>O>As,故答案为:F>O>As;
(3)①NH4+中价层电子对=4+![]() =4,所以中心原子原子轨道为sp3杂化,该离子中含有不孤电子对,所以其空间构型为正四面体,故答案为:正四面体;
=4,所以中心原子原子轨道为sp3杂化,该离子中含有不孤电子对,所以其空间构型为正四面体,故答案为:正四面体;
②(NH4)3FeF6是离子化学物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,故答案为:abd;
③SCN-中各原子最外层均满足8电子稳定结构,该原子团的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,所以C原子的杂化方式为sp,σ键与π键个数的比为1:1,故答案为:sp;1:1;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体;分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,故答案为:FeCl3是分子晶体,FeF3是离子晶体;
(5)该晶胞中Fe原子个数是4,S原子个数=![]() ,根据S和Fe原子个数之比确定化学式为FeS;该晶胞的质量m=
,根据S和Fe原子个数之比确定化学式为FeS;该晶胞的质量m=![]() =
=![]() ,该晶胞的体积=
,该晶胞的体积=![]() =
=![]() cm3;晶胞棱长=
cm3;晶胞棱长=![]() cm=
cm=![]() 该晶胞中距离最近的S原子之间的距离为晶胞棱长的
该晶胞中距离最近的S原子之间的距离为晶胞棱长的![]() 倍,即
倍,即![]() ×
×![]() cm。
cm。
故答案为:FeS;![]() ×
×![]() cm。
cm。

【题目】用图所示装置检验乙烯时不需要除杂的是

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |