题目内容
下列说法正确的是
| A.含有离子键的化合物一定是离子化合物 |
| B.含有共价键的化合物一定是共价化合物 |
| C.所有物质都含有共价键 |
| D.均由非金属元素形成的化合物不可能是离子化合物 |
A
解析试题分析:含有离子键的化合物一定是离子化合物,全部由共价键形成的化合物是共价化合物,这说明在离子化合物中可能含有共价键,但在共价化合物中一定不可能含有离子键,因此选项A正确,B不正确。稀有气体单质分子中不存在化学键,C不正确;均由非金属元素形成的化合物要可能是离子化合物,例如氯化铵等铵盐,D不正确,答案选A。
考点:考查化学键以及化学键与化合物关系的判断
点评:该题是中等难度的试题,也是高考中的常见题型和重要的考点。主要是考查学生对化学键含义以及化学键与化合物关系的熟悉了解程度,有利于培养学生规范的逻辑思维能力和灵活应变能力。该题的易错点是选项C。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
| A.①③⑤ | B.②④⑤ | C.②③④ | D.①③ |
科学家曾预言一种可用作炸药的物质,分子式为C(N3)4,其爆炸反应方程式为:C(N3)4=C+6N2↑,下列说法一定正确的是
| A.该物质为离子晶体 |
| B.该物质可通过C60吸附N2直接制得 |
| C.18g该物质完全分解产生13.44LN2 |
| D.C(N3)4中碳元素为正价 |
关于含正离子N5+的化合物N5ASF6,下列叙述中错误的是( )
| A.N5+共有34个核外电子 |
| B.N5+中氮原子间以离子键结合 |
| C.化合物N5ASF6中AS的化合价为+1价 |
| D.化合物N5ASF6为离子化合物 |
下列物质中既含有离子键又含有共价键的是
| A.H2O | B.CaCl2 | C.NaOH | D.Cl2 |
下列各组中的两种化合物,所含化学键类型和化合物类型完全相同的是
| A.Na2O 和Na2O2 |
| B.CaCl2和 Na2S |
| C.CO2和 CaO |
| D.HCl 和NaOH |
下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是
| A.2Na2O2+2CO2=2Na2CO3+O2 | B.2Na+2H2O=2NaOH+H2↑ |
| C.Cl2+H2O?=?HCl+HclO | D.Na2CO3+BaCl2=BaCO3↓+2NaCl |
水是生命之源,与人类的生活密切相关。在化学实验和科学研究中,水有多种用途。
(1)下列说法中正确的是 (填序号)。
| A.每一个水分子内含有两个氢键 |
| B.水分子间存在范德华力,所以水分子稳定 |
| C.分子间形成的氢键使水的熔点和沸点升高 |
| D.冰熔化时水分子内共价键发生断裂 |
(3)水分子在特定条件下易形成水合氢离子(H3O+)。其中含有的化学键为 。
(4)如果需要增大水的电离程度,除了升高温度外,还可以采用的方法有 (回答一种即可)。若室温时,将某一元酸HA加水配成0.1 mol·L-1的稀溶液,此时HA在水中有0.1%发生电离,则由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
(5)将一定量的Na2SO3固体溶于水,所得溶液中的电荷守恒关系式为 。
(6)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差异进行发电。已知该电池用金属银做负极,正极反应为5MnO2 +2Na++2e-
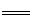 Na2Mn5O10,请写出电池总反应式 。
Na2Mn5O10,请写出电池总反应式 。