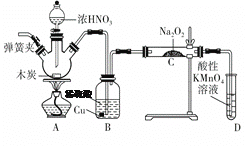
��Ŀ����
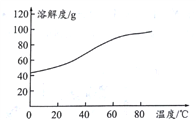
����Ŀ�����������һ�����Ϳɳ����,����ͨ������,�õ���ܽϳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH����ش���������:
3Zn(OH)2+2Fe(OH)3+4KOH����ش���������:
(1)������صĸ���������____��
(2)�ŵ�ʱ,��������____(���������ԭ��)��Ӧ;��֪������ӦΪZn-2e-+2OH-====Zn(OH)2,��������ӦΪ_______________________��
(3)�ŵ�ʱ,____(���������)��������Һ�ļ�����ǿ��
���𰸡� Zn��п ��ԭ FeO42-+3e-+4H2O�TFe��OH��3+5OH- ��
��������������ԭ����и�������ʧȥ���ӵ�������Ӧ�����������õ����ӵĻ�ԭ��Ӧ�����ݸ�����ص��ܷ�Ӧ�жϻ�ԭ���������������ԭ���ԭ���������
��⣺��1�������ܷ�Ӧʽ��֪пʧȥ���ӣ�����������Ӧ�����Ը�����صĸ���������п��
��2���ŵ�ʱ,���������õ����ӵĻ�ԭ��Ӧ����֪������ӦΪ3Zn-6e-+6OH-��3Zn(OH)2���������ܷ�Ӧʽ��ȥ������Ӧʽ���ɵõ�������ӦΪFeO42-+3e-+4H2O��Fe��OH��3+5OH-��
��3���ŵ�ʱ������ӦΪFeO42-+3e-+4H2O��Fe��OH��3+5OH-����Ӧ�в�����������������Ũ��������������������Һ�ļ�����ǿ��

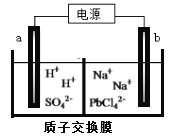
����Ŀ������ͼ��ʾ��װ���У��۲쵽������ָ��ƫת��M����֣�N����ϸ������õ������Һ��������С���ɴ��ж��±�������M��N��P���ʣ����п��Գ������ǣ� ��
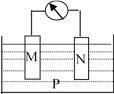
M | N | P | |
A | Zn | Cu | ϡ������Һ |
B | Cu | Fe | ϡ���� |
C | Ag | Zn | ��������Һ |
D | Zn | Fe | ����������Һ |
A. A B. B C. C D. D
����Ŀ��һ���¶��£���10 mL 0.40 mol��L-1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++O2��+2H+
2Fe2++O2��+2H+
�� H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
��Ӧ�����������仯����ͼ��ʾ������˵������ȷ����

A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol��L-1��min-1
B. Fe3+�������Ǽӿ��������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq)![]() 2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
����Ŀ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ��ռ��е����ʲ����ᷴӦ���������ʵ��ش�
��1���������õ�8.8g�ռ���Ʒ���Ƴ�500mL����Һ�����ƹ���ʹ�õ���Ҫ������500mL����ƿ����Ͳ���ձ�����ͷ�ι��⣬����һ�ֱ���ʹ�õ������� ��
��2����ʽ�ζ�����ȡ10.00mL����Һ����ƿ�У����뼸�η�̪��
��3����0.20molL��1�ı�����ζ�����Һ���жϵζ��յ�������ǣ� ��
��4�����ʵ�������ȷ���ӵζ���ʼ����������Һ�е�����Ũ�ȹ�ϵ���Գ��ֵ����������ĸ��ţ�
A.c��Na+����c��Cl������c��H+����c��OH����
B.c��Na+����c��OH������c��Cl������c��H+��
C.c��Na+��+c��H+��=c��OH����+c��Cl����
D.c��Cl����+c��Na+����c��OH����+c��H+��
��5�������������ݼ��㣬c��NaOH�� mol/L
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 10.00 | 0.60 | 20.50 |
�ڶ��� | 10.00 | 3.00 | 23.10 |
��6�������������֣�����ʵ��IJⶨ������ռ��ʵ�ʴ���ƫ�ߣ�������Ŀ���ԭ����
A.�ζ�ǰƽ�ӣ��ζ�����
B.δ�ñ�Һ��ϴ�ζ���
C.�ô���Һ��ϴ��ƿ
D.��С�Ľ���Һ������ƿ���森