题目内容
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。
(1)32.0g该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(25°C,101kPa),则肼完全燃烧的热化学方程式 。
 (2)肼——空气燃料电池是一种无污染的清洁的碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,作负极的燃料是 (填化学式);正极的电极反应式是 。
(2)肼——空气燃料电池是一种无污染的清洁的碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,作负极的燃料是 (填化学式);正极的电极反应式是 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是________________________。
②假设使用肼一空气燃烧电池作为本过程中的电源,锌片的质量
变化是128g,则肼一空气燃料电池理论上消耗标准状况下的空气_____L
(假设空气中氧气体积含量为20%)
(1)N2H4(l)+O2(g)=N2(g) +2H2O(l) △H= -624kJ/mol
(2) N2H4 O2+2H2O+4e- =4OH-
(3)Cu2++2e-=Cu 112L
解析:
解析(1)热化学方式书写时应特别注意:①要标物质的状态;②方程式系数与焓变一一对应。
(2)根据总反应式:N2H4+O2=N2 +2H2O,可知N2H4失电子被氧化,故N2H4作负极燃料,O2
得电子被还原,故在正极发生反应。
(3)①锌与电源的负极相连,溶液中Cu2+得电子被还原,即反应式为Cu2++2e-=Cu。
②锌片质量的变化就是析出铜的质量,据得失电子守恒知:2Cu—---O2,n(O2)=O.5n(Cu)=1mo,故O2的体积为224L,即空气的体积为224L÷20%=112L.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料. 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
 肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.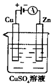 肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )
肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )