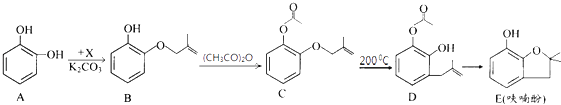
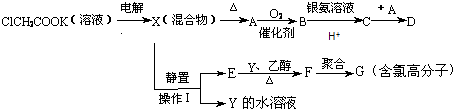
题目内容
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
【答案】
(1)0.0035mol/(L?min)
(2)0.053
(3)125;60%;是
(4)大于
(5)越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大
【解析】解:I.(1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.26mol,减少了0.14mol,
C8H10(g) | C8H8(g)+ | H2(g) | |
起始(mol) | 0.40 | 0 | 0 |
变化(mol) | 0.14 | 0.14 | 0.4 |
20min(mol) | 0.26 | 0.14 | 0.14 |
v(H2)= ![]() =0.0035mol/(Lmin)
=0.0035mol/(Lmin)
所以答案是:0.0035mol/(Lmin);
(2)
C8H10(g) | C8H8(g)+ | H2(g) | |
起始(mol/L) | 0.20 | 0 | 0 |
变化(mol/L) | 0.08 | 0.08 | 0.08 |
30min(mol/L) | 0.12 | 0.08 | 0.08 |
化学平衡常数K= ![]() =
= ![]() =0.053;
=0.053;
所以答案是:0.053;(3)C8H10(g)C8H8(g)+H2(g),反应焓变△H=反应物键能总和﹣生成物键能总和=10×412.5+4×348+3×612﹣8×412.5﹣3×348﹣4×612﹣436=125KJ/mol,根据C8H10(g)C8H8(g)+H2(g)△H=125kJmol﹣1 , 可知 C8H8(g)+H2(g)C8H10(g)△H=﹣125kJmol﹣1 , 有30kJ热量放出时,消耗的H2量为0.24mol,所以氢气转化率= ![]() ×100%=
×100%= ![]() ×100%=60%;
×100%=60%;
根据(2)知:平衡常数=0.053,则C8H8(g)+H2(g)C8H10(g)的平衡常数为 ![]() =18.75,
=18.75,
C8H8(g)+ | H2(g) | C8H10(g) | |
起始(mol/L) | 0.2 | 0.2 | 0 |
变化(mol/L) | 0.12 | 0.12 | 0.12 |
某时刻(mol/L) | 0.08 | 0.08 | 0.12 |
![]() =
= ![]() =18.75=18.75,反应达到平衡状态;
=18.75=18.75,反应达到平衡状态;
所以答案是:125;60%;是;Ⅱ.(4)C8H10(g)C8H8(g)+H2(g)△H=125kJmol﹣1 , 温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;所以答案是:大于;(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;所以答案是:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大.
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t,以及对化学平衡状态本质及特征的理解,了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据所学知识,完成下面题目:
(1)亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应获得:NO(g)+Cl2(g)═2ClNO(g).①氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H1 K1
4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H2 K2
2NO(g)+Cl2(g)2ClNO(g)△H3 K3
则△H3=(用△H1和△H2表示),K3=(用K1和K2表示).
②NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O.室温下,用一定量的NaOH
溶液吸收NO、NO2混合气体,得到0.1mol/L的NaNO2溶液.已知HNO2的电离常数Ka=7.1×10﹣4 ,
那么室温下NO2﹣的水解常数Kh= , 0.1mol/L NaNO2溶液中从c(Na+ )、c(OH﹣ )、c(NO2﹣ )、c(HNO2)的大小顺序为 .
(2)在3.0L密闭容器中,通入0.10mol CH4和0.20molNO2 , 在一定温度下进行反应,CH4(g)+2NO2(g)CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
①由表中数据计算0~4min内v(NO2)= , 该温度下的平衡常数K=(不必带单位).
②在一恒容装置中,通入一定量CH4和NO2 , 测得在相同时间内,在不同温度下,NO2的转化率如图(横坐标为反应温度,纵坐标为NO2转化率/%):
则下列叙述正确的是 .
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v (逆)>e点的 v (逆)
C.平衡常数:c点=d点
D.提高b点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
【题目】H2O2是常用的绿色氧化剂,H2S是还原剂,但H2S会对环境和人体健康带来极大危害。
I.H2S的除去,生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_____。
(2)由图甲和图乙判断他用硫杆菌的最佳条件为_______。在最佳条件下,该反应的加热方式为_________,若反应温度过高,反应速率下降,其原因是__________。

II.为研究硫酸饮的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验。将表中所给的溶液分别加入A、B、C、D四个反应瓶中,收集产生的气体,在关数据如下:
实验溶液 | A/mL | B/mL | C/mL | D/mL |
0.4mol/LFe2(SO4)3溶液 | 0 | 1.0 | 2.0 | V1 |
30%H2O2溶液 | V2 | 20.0 | 20.0 | 20.0 |
H2O | 18.0 | 17.0 | V3 | 15.0 |
(1)实验过程中需记录的数据是___________。
(2)上表中的V2=_______,V3=_________。