题目内容
5.请写出下列物质的电子式.NaCl
 H2O
H2O CO2
CO2 N2
N2 .
.
分析 首先判断单质或化合物的类型,离子化合物阴离子带电荷且用“[]”,共价化合物不带电荷,注意各原子或离子满足稳定结构.
NaCl为离子化合物,有钠离子与氯离子构成,书写氯离子时注意用中括号;
H2O是共价化合物,氧原子分别与两个氢原子通过一对共用电子对结合;
二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;
氮气中存在3对共用电子对,氮原子最外层达到8个电子.
解答 解:NaCl为离子化合物,由钠离子与氯离子构成,电子式为: ;
;
水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,
,
二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
氮气中存在氮氮三键,氮气的电子式为 ,
,
故答案为: ;
; ;
; ;
; .
.
点评 本题考查电子式的书写知识,题目难度不大,结合物质的成键情况并根据电子式的书写规则解答.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
15.从2015年1月1日起我国施行新的《环境保护法》.下列做法不应该提倡的是( )
| A. | 将煤汽化和液化,得到清洁的燃料和化工原料 | |
| B. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| C. | 加强生活污水的脱氮除磷的处理,遏制水体富营养化 | |
| D. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 |
11.运用元素周期律分析,下列说法正确的是( )
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的最外层电子数等于元素的最高化合价 | |
| C. | 原子序数越大,原子半径越大 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
8.用NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24LCHCl3中含有碳氯键数目为0.3NA | |
| B. | 25℃时,0.1mol/L的Na2CO3溶液中含有Na+的数目为0.02NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 1molNa2O和1molNa2O2的混合物中,含有的离子总数为7NA |
9.煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料,下列不属于以煤、石油和天然气为主要原料生产的合成材料是( )
| A. | 塑料 | B. | 玻璃 | C. | 淀粉 | D. | 合成纤维 |
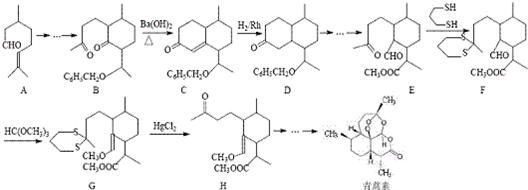
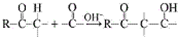
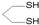 用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.
用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.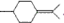 ,则异蒲勒醇的结构简式为:
,则异蒲勒醇的结构简式为: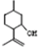 .
.



 .
.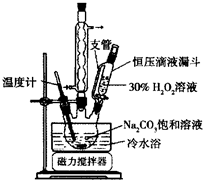 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.