题目内容
在500 mL CuSO4和Fe2(SO4)3的混合溶液中加入21.7 g铁粉,待反应完全后,得到16.8 g残留固体.在滤液中加入400 mL 4 mol·L-1的BaCl2溶液,恰好使溶液中的![]() 完全沉淀.求原混合溶液中CuSO4和Fe2(SO4)3的物质的量浓度.
完全沉淀.求原混合溶液中CuSO4和Fe2(SO4)3的物质的量浓度.
解析:
|
解析:本题的关键是要弄清16.8 g残留固体是什么物质. 在判断Fe是否过量时运用“极端假设法”,这是经常使用的基本解题方法之一. n( 若原混合溶液中溶质全部是CuSO4,由方程式Fe+CuSO4 若原混合溶液中溶质全部是Fe2(SO4)3,由方程式Fe+Fe2(SO4)3 因而实际需Fe的质量应介于29.9~89.6 g之间,现加入的Fe为21.7 g,所以Fe的量不足,说明得到的16.8 g固体全部是Cu. 设原混合溶液中Fe2(SO4)3为x mol,CuSO4为y mol.由于氧化性Fe3+>Cu2+,故Fe先与Fe2(SO4)3反应. Fe+Fe2(SO4)3 x x Fe+CuSO4 ∴ ∴c[Fe2(SO4)3]=0.25 mol·L-1,c(CuSO4)=2.45 mol·L-1. |

用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为( )
| A.0.5 mol/L | B.2 mol/L | C.l mol/L | D.无法确定 |
在500 mL KNO3和Cu(NO3)2的混合溶液中c(NO- 3)="6" mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中 c(K+)为2 mol?L-1 | B.上述电解过程中转移电子总数为2 NA |
| C.电解得到的Cu的物质的量为0.5 mol | D.电解后溶液中c(H+)为2 mol·L-1 |
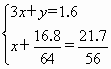 解得:x=0.125,y=1.225
解得:x=0.125,y=1.225




