题目内容
将0.1 mol/L的NH3·H2O溶液加水稀释,下列说法正确的是( )
| A.c(NH)/c(NH3·H2O)比值减小 | B.OH-个数将减少 |
| C.c(OH-)/c(NH3·H2O)比值减小 | D.NH4+浓度将减小 |
D
解析试题分析:在0.1 mol/L的NH3·H2O溶液中存在电离平衡:NH3·H2O NH4++OH-。当加水稀释时,A. 假如平衡不发生移动c(NH3·H2O)、c(NH4+)的浓度都减小,由于生成物的系数大,稀释的倍数多,所以平衡向电离的方向移动,c(NH3·H2O)比稀释的倍数大,c(NH4+)比稀释的倍数小,所以c(NH4+)/c(NH3·H2O)比值增大。错误。B.加水稀释促进了物质的大量,所以OH-个数将增大。错误。C.加水时c(OH-)、c(NH3·H2O)都减小,因为平衡正向移动,所以c(OH-)减小的倍数小于c(NH3·H2O)减小的不是,因此c(OH-)/c(NH3·H2O)比值增大。错误。D.加水稀释,尽管平衡向电离的方向移动,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,因此NH4+浓度将减小。正确。
NH4++OH-。当加水稀释时,A. 假如平衡不发生移动c(NH3·H2O)、c(NH4+)的浓度都减小,由于生成物的系数大,稀释的倍数多,所以平衡向电离的方向移动,c(NH3·H2O)比稀释的倍数大,c(NH4+)比稀释的倍数小,所以c(NH4+)/c(NH3·H2O)比值增大。错误。B.加水稀释促进了物质的大量,所以OH-个数将增大。错误。C.加水时c(OH-)、c(NH3·H2O)都减小,因为平衡正向移动,所以c(OH-)减小的倍数小于c(NH3·H2O)减小的不是,因此c(OH-)/c(NH3·H2O)比值增大。错误。D.加水稀释,尽管平衡向电离的方向移动,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,因此NH4+浓度将减小。正确。
考点:考查加水稀释弱电解质电离平衡及各种微粒浓度大小比较的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案已知一定温度下,有下列难溶电解质的相关数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| KSP/250C | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A.向该混合溶液中加过量铁粉,能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该混合溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+ c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调pH至3~4后过滤,能得到纯净的CuSO4溶液
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液。下列说法不正确的是( )
| A.c(NH4+);③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
同时对农作物施用含N、P、K的三种化肥,对给定的下列化肥①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4,⑤氨水,最适当的组合是( )
| A.①③④ | B.①③⑤ | C.②③④ | D.②③⑤ |
下列表达不正确的是
| A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS- =H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c (CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
[双选题]在25℃某稀溶液中,由水电离产生的c(H+)=10-13 mol·L-1,下列有关溶液的叙述正确的是( )
| A.该溶液一定呈酸性 |
| B.该溶液一定呈碱性 |
| C.该溶液的pH可能约为1 |
| D.该溶液的pH可能约为13 |
对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是( )
| A.Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化 |
| B.Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化 |
C.MgCO3电离出的CO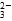 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀 |
D.MgCO3电离出的CO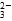 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀 |
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HC+H+ HC+H+ |
C.C+H2O HC+OH- HC+OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |
下列溶液在空气中加热、蒸干、灼烧后,所得固体为原溶液中的溶质的是( )
| A.NaHCO3 | B.KMnO4 | C.FeCl3 | D.NaCl |