题目内容
欲用98%的浓硫酸(g=1.84g?cm-3)配制成浓度为0.5mol?L-1的稀硫酸500ml.
(1)选用的主要仪器有:① ,② ,③ ,④ ,⑤ .
(2)请将下列各操作,按正确的序号填在横线上.
A.用量筒量取浓H2SO4
B、反复颠倒摇匀
C、用胶头滴管加蒸馏水至刻度线
D、洗净所用仪器
E、稀释浓H2SO4
F、将溶液转入容量瓶
其操作正确的顺序依次为
(3)简要回答下列问题:
①所需浓硫酸的体积为 mL.
②如果实验室有15mL、20mL、50mL的量筒应选用 mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度 (“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是 ,若搅拌过程中有液体溅出结果会使浓度偏 .
④在转入容量瓶前烧杯中液体应 ,否则会使浓度偏 ;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度 .
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度 ;仰视则使浓度 .
(1)选用的主要仪器有:①
(2)请将下列各操作,按正确的序号填在横线上.
A.用量筒量取浓H2SO4
B、反复颠倒摇匀
C、用胶头滴管加蒸馏水至刻度线
D、洗净所用仪器
E、稀释浓H2SO4
F、将溶液转入容量瓶
其操作正确的顺序依次为
(3)简要回答下列问题:
①所需浓硫酸的体积为
②如果实验室有15mL、20mL、50mL的量筒应选用
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是
④在转入容量瓶前烧杯中液体应
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据配制一定物质的量浓度的溶液的步骤选用需要的玻璃仪器;
(2)根据配制一定物质的量浓度的溶液的步骤选排序;
(3)①依据C=
计算浓硫酸的物质的量浓度,依据稀释前后溶质的物质的量保持不变计算需要浓硫酸的体积;
②依据需要浓硫酸的体积选择合适的量筒,发现量筒不干净用水洗净后直接量取将使浓硫酸稀释,量取的溶质硫酸的物质的量偏小;
③浓硫酸稀释放出大量的热,用玻璃棒不断搅拌可以是热量散失,防止液体飞溅;若搅拌过程中有液体溅出,导致溶质的物质的量偏小;
④移液前溶液应冷却到室温,否则会导致溶液的体积偏小;洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,防止溶质损耗,溶质的物质的量偏小;
⑤俯视会使溶液体积偏小,仰视会使溶液体积偏大;
(2)根据配制一定物质的量浓度的溶液的步骤选排序;
(3)①依据C=
| 1000ρω |
| M |
②依据需要浓硫酸的体积选择合适的量筒,发现量筒不干净用水洗净后直接量取将使浓硫酸稀释,量取的溶质硫酸的物质的量偏小;
③浓硫酸稀释放出大量的热,用玻璃棒不断搅拌可以是热量散失,防止液体飞溅;若搅拌过程中有液体溅出,导致溶质的物质的量偏小;
④移液前溶液应冷却到室温,否则会导致溶液的体积偏小;洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,防止溶质损耗,溶质的物质的量偏小;
⑤俯视会使溶液体积偏小,仰视会使溶液体积偏大;
解答:
解:(1)配制浓度为0.5mol?L-1的稀硫酸500ml的步骤为::计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要的玻璃仪器仪器有:500mL容量瓶、玻璃棒、烧杯、胶头滴管、量筒;
故答案为:500mL容量瓶、玻璃棒、烧杯、胶头滴管、量筒;
(2)配制浓度为0.5mol?L-1的稀硫酸500ml的步骤为::计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确的顺序为:AEFDCB;
故答案为:AEFDCB;
(3)①98%的浓硫酸(g=1.84g?cm-3)的物质的量浓度=
=18.4mol/L,设需要浓硫酸Vml,依据稀释前后溶质的物质的量保持不变得:V×18.4mol?L-1=0.5mol?L-1×500ml,解得V=13.6ml;
故答案为:13.6;
②量取13.6ml浓硫酸需要选用15ml量筒;发现量筒不干净用水洗净后直接量取将使浓硫酸稀释,量取的溶质硫酸的物质的量偏小,依据C=
可知,所配溶液的浓度偏低;
故答案为:15;偏低;
③浓硫酸稀释放出大量的热,用玻璃棒不断搅拌可以是热量散失,防止液体飞溅;若搅拌过程中有液体溅出,导致溶质的物质的量偏小,依据C=
可知,所配溶液的浓度偏低;
故答案为:使产生的热量不断散失;偏低;
④移液前溶液应冷却到室温,否则会导致溶液的体积偏小,依据C=
可知,所配溶液的浓度偏高;洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,防止溶质损耗,溶质的物质的量偏小,依据C=
可知,溶液浓度偏低;
故答案为:冷却到室温;偏高;偏低;
⑤俯视会使溶液体积偏小,依据C=
可知,溶液浓度偏高;仰视会使溶液体积偏大,依据C=
可知,溶液浓度偏低;
故答案为:偏高;偏低;
故答案为:500mL容量瓶、玻璃棒、烧杯、胶头滴管、量筒;
(2)配制浓度为0.5mol?L-1的稀硫酸500ml的步骤为::计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,所以正确的顺序为:AEFDCB;
故答案为:AEFDCB;
(3)①98%的浓硫酸(g=1.84g?cm-3)的物质的量浓度=
| 1000×1.84×98% |
| 98 |
故答案为:13.6;
②量取13.6ml浓硫酸需要选用15ml量筒;发现量筒不干净用水洗净后直接量取将使浓硫酸稀释,量取的溶质硫酸的物质的量偏小,依据C=
| n |
| V |
故答案为:15;偏低;
③浓硫酸稀释放出大量的热,用玻璃棒不断搅拌可以是热量散失,防止液体飞溅;若搅拌过程中有液体溅出,导致溶质的物质的量偏小,依据C=
| n |
| V |
故答案为:使产生的热量不断散失;偏低;
④移液前溶液应冷却到室温,否则会导致溶液的体积偏小,依据C=
| n |
| V |
| n |
| V |
故答案为:冷却到室温;偏高;偏低;
⑤俯视会使溶液体积偏小,依据C=
| n |
| V |
| n |
| V |
故答案为:偏高;偏低;
点评:本题考查了配制一定物质的量浓度的溶液的方法,明确配制原理和过程是解题关键,注意仪器的使用和误差分析,题目难度不大.

练习册系列答案
相关题目
关于中和热测定实验的下列说法不正确的是( )


| A、烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B、使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C、向盛装酸的烧杯中加碱时要小心缓慢 |
| D、测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度 |
下列说法正确的是( )
A、钾(K)原子基态的原子结构示意图为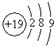 |
B、H2O电子式为 |
| C、Mg的原子基态电子排布式为1s22s22p63s23p1 |
| D、Ca2+离子基态电子排布式为1s22s22p63s23p6 |
某学生用托盘天平称量时,误将药品与砝码的位置放颠倒了,待平衡时,称得药品质量的读数为9.5g(1g以下用游码),则药品的实际质量为( )
| A、9g | B、10g |
| C、8.5g | D、8g |
有4种有机物:① ,②
,② ,③
,③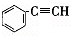 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )
 ,②
,② ,③
,③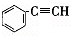 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |
除去NaCl溶液中溶解的杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A、NaCl溶液(Na2SO4)加入过量BaCl2溶液后,过滤 |
| B、NaCl溶液(MgCl2)加入适量NaOH溶液后,过滤 |
| C、NaCl溶液(CaCl2)加入适量Na2CO3溶液后,过滤 |
| D、NaCl溶液(碘)加入四氯化碳后,分液 |
已知:Ka1(H2CO3)>Ka(C6H5OH)>Ka2(H2CO3)下列反应不能发生的是(Ka1、Ka2各指一级、二级电离常数)
( )
( )
| A、H2CO3+CO32-→2HCO3- | ||
B、 +H2CO3→ +H2CO3→ +HCO +HCO
| ||
C、 +HCO3-→ +HCO3-→ +CO32- +CO32- | ||
D、 +CO32-→ +CO32-→ +HCO3- +HCO3- |
 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL 冰醋酸混合,分别进行制取乙酸乙酯的研究.