题目内容
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液和20.00mL 0.1000mol/L CH3COOH溶液,得到2条滴定曲线,如图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是 (填“图1”或“图2”);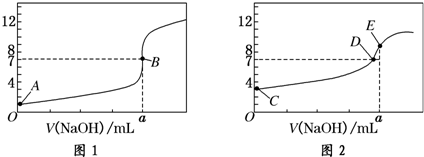
(2)a= mL;
(3)c(Na+)=c(CH3COO-)的点是
(4)E点对应离子浓度由大到小的顺序为 .
(5)该温度下CH3COOH的电离常数为 (列式代入数据计算)
(6)当NaOH溶液滴定CH3COOH溶液过程中,NaOH溶液消耗了10.00mL时,则此时混合液中c(CH3COOH) c(CH3COO-) (“>”或“<”或“=”).
(7)t℃时,浓度均为0.0035mol/L的CH3COONa和NaOH的混合液pH=11,则溶液中c(H+)+c(CH3COO-)+2c(CH3COOH)= (t℃时,Kw=4×10-14 mol2/L2)
(1)由A、C点判断,滴定HCl溶液的曲线是

(2)a=
(3)c(Na+)=c(CH3COO-)的点是
(4)E点对应离子浓度由大到小的顺序为
(5)该温度下CH3COOH的电离常数为
(6)当NaOH溶液滴定CH3COOH溶液过程中,NaOH溶液消耗了10.00mL时,则此时混合液中c(CH3COOH)
(7)t℃时,浓度均为0.0035mol/L的CH3COONa和NaOH的混合液pH=11,则溶液中c(H+)+c(CH3COO-)+2c(CH3COOH)=
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸溶液的初始pH确定盐酸滴定曲线;
(2)根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
(3)溶液中c(Na+)=c(CH3COO-),则该溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性;
(4)根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断离子浓度;
(5)电离平衡常数只与温度有关,与溶液的浓度无关,根据Ka=
计算;
(6)当滴加10mL NaOH溶液时,溶质为醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解;
(7)根据电荷守恒可知,[Na+]-[CH3COO-]=[OH-]-[H+],结合溶液中浓度均为0.0035mol/L的CH3COONa和NaOH进行解答;
(2)根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
(3)溶液中c(Na+)=c(CH3COO-),则该溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性;
(4)根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断离子浓度;
(5)电离平衡常数只与温度有关,与溶液的浓度无关,根据Ka=
| C(H+).C(CH3COO-) |
| C(CH3COOH) |
(6)当滴加10mL NaOH溶液时,溶质为醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解;
(7)根据电荷守恒可知,[Na+]-[CH3COO-]=[OH-]-[H+],结合溶液中浓度均为0.0035mol/L的CH3COONa和NaOH进行解答;
解答:
解:(1)如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,
故答案为:图1;
(2)滴定20.00mL 0.1000mol/L HCl溶液,NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,滴定终点时n(HCl)=n(NaOH),则a=20.00mL,
故答案为:20.00;
(3)c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,
故答案为:D;
(4)根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)由CH3COOH?CH3COO-+H+知,c(H+)=c(CH3COO-)=已经电离的[c(CH3COOH)],溶液中未电离的醋酸浓度为(0.1-0.0001)mol/L,Ka=
=
=
,
故答案为:
;
(6)滴定CH3COOH溶液的过程中,当滴加10mL NaOH溶液时,反应后的溶质为醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解,所以溶液中醋酸根离子浓度大于醋酸浓度,溶液显示酸性,
故答案为:<;
(7)PH=11,溶液中c(H+)=1×10-11mol/L、t℃时,Kw=4×10-14 mol2/L2,则c(OH-)=4×10-3mol/L,
根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),t℃时,浓度均为0.0035mol/L的CH3COONa和NaOH的混合液中c(Na+)=2[c(CH3COO-)+c(CH3COOH)],则c(H+)+c(CH3COO-)+2c(CH3COOH)=c(OH-)=4×10-3mol/L,
故答案为:4×10-3mol/L;
故答案为:图1;
(2)滴定20.00mL 0.1000mol/L HCl溶液,NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,滴定终点时n(HCl)=n(NaOH),则a=20.00mL,
故答案为:20.00;
(3)c(Na+)=c(CH3COO-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(OH-)=c(H+),则溶液呈中性,pH=7,
故答案为:D;
(4)根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)>c(CH3COO-),盐类水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(5)由CH3COOH?CH3COO-+H+知,c(H+)=c(CH3COO-)=已经电离的[c(CH3COOH)],溶液中未电离的醋酸浓度为(0.1-0.0001)mol/L,Ka=
| C(H+).C(CH3COO-) |
| C(CH3COOH) |
| 0.0001×0.0001 |
| 0.1-0.0001 |
| 1 |
| 107-104 |
故答案为:
| 1 |
| 107-104 |
(6)滴定CH3COOH溶液的过程中,当滴加10mL NaOH溶液时,反应后的溶质为醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解,所以溶液中醋酸根离子浓度大于醋酸浓度,溶液显示酸性,
故答案为:<;
(7)PH=11,溶液中c(H+)=1×10-11mol/L、t℃时,Kw=4×10-14 mol2/L2,则c(OH-)=4×10-3mol/L,
根据电荷守恒可得:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),t℃时,浓度均为0.0035mol/L的CH3COONa和NaOH的混合液中c(Na+)=2[c(CH3COO-)+c(CH3COOH)],则c(H+)+c(CH3COO-)+2c(CH3COOH)=c(OH-)=4×10-3mol/L,
故答案为:4×10-3mol/L;
点评:本题考查了酸碱混合时溶液定性判断及有关pH的简单计算,题目难度中等,注意掌握根据电荷守恒、物料守恒比较溶液中离子浓度定性关系的方法.注意过程的分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质的性质排序正确的是( )
| A、酸性:H3PO4>H2SO4>HClO4 |
| B、水溶性:NH3>CO2>SO2>H2S |
| C、热稳定性:HF>H2O>NH3 |
| D、沸点:新戊烷>正戊烷>丁烷 |
在100mL 0.5mol/L的AlCl3溶液中加入100mLNaOH溶液,得到0.01mol Al(OH)3沉淀,则NaOH溶液的物质的量浓度可能为( )
| A、0.6 mol/L |
| B、1.6 mol/L |
| C、1.9 mol/L |
| D、2.2 mol/L |
用一种试剂鉴别1-己烯、碘化钾溶液、苯三种液体,应选用( )
| A、盐酸 |
| B、FeCl3溶液 |
| C、溴水 |
| D、四氯化碳 |
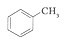 和
和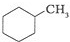 .其中互为同分异构体的是
.其中互为同分异构体的是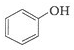 )、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).
)、乙醛(CH3CHO)、乙酸(CH3COOH)、乙醇(CH3CH2OH).