题目内容
某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。
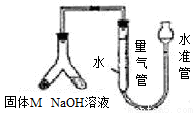
(1)如何检验该装置的气密性 。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式 。
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL,则固体M中铝的质量(m)范围为 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积 (填“>”“<”“=”)VmL。
(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程) (填“符合”或“不符合”)。
(1)安装好装置并在量气管内加人水,向下移动水准管,静置片刻。若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑ (3)0<m<0.04g(或m<0.04g (4)> (5)符合
【解析】
试题分析:(1)装置气密性的检验,原理通常是想办法造成装置不同部位气体有压强差,并产生某种明显的现象。所以根据该装置的特点可知,检验方法是安装好装置并在量气管内加人水,向下移动水准管,静置片刻。若水准管中液面与量气管液面维持一定的高度差,说明装量密封。
(2)镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)由于量气管最大量程为50mL,这说明反应中最多只能产生50ml氢气,标准状况下的物质的量= =
= mol。所以根据方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知最多消耗率的质量=
mol。所以根据方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知最多消耗率的质量= mol×
mol× ×27g/mol=0.04g,因此固体M中铝的质量(m)范围为0<m<0.04g。
×27g/mol=0.04g,因此固体M中铝的质量(m)范围为0<m<0.04g。
(4)由于合金中镁能和盐酸反应放出氢气,所以若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积>VmL。
(5)V=44.8mL(标准状况),则氢气的物质的量= =0.002mol,所以消耗铝的质量=0.002mol×
=0.002mol,所以消耗铝的质量=0.002mol× ×27g/mol=0.036g=36mg。则合金中铝的质量分数=
×27g/mol=0.036g=36mg。则合金中铝的质量分数= ×100%=94.74%>78%,所以符合国家标准。
×100%=94.74%>78%,所以符合国家标准。
考点:考查合金中元素含量测定的实验探究、设计、评价以及计算等

 阅读快车系列答案
阅读快车系列答案