题目内容
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: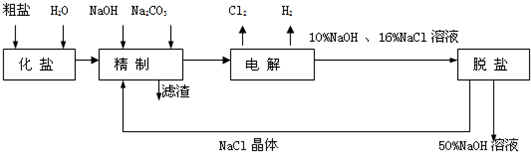
依据上图,完成下列填空:
(1)与电源负极相连的电极附近,溶液pH值
(2)写出电解饱和食盐水的化学方程式
(3)如果粗盐中SO42-含量较高,必须添加钡式剂除去SO42-,
该钡试剂可以是
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)判断钡试剂已经过量的方法是
(5)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
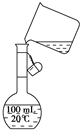
(6)为检验精盐纯度,需配制150mL0.2mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是
分析:(1)在电解池中,和电源的正极相连的是电解池的阳极,该极上是氯离子发生失电子的氧化反应,氯气能使湿润的淀粉碘化钾试纸变蓝;
(2)电解饱和食盐水的产物是氢氧化钠和氢气、氯气;
(3)粗盐的提纯中,加氯化钡可以除去硫酸根离子,同时氯离子的进入不会引及杂质;
(4)根据硫酸根离子会和钡离子之间反应生成硫酸钡白色沉淀来回答;
(5)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(6)根据配制一定物质的量浓度溶液的方法和操作顺序来回答.
(2)电解饱和食盐水的产物是氢氧化钠和氢气、氯气;
(3)粗盐的提纯中,加氯化钡可以除去硫酸根离子,同时氯离子的进入不会引及杂质;
(4)根据硫酸根离子会和钡离子之间反应生成硫酸钡白色沉淀来回答;
(5)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(6)根据配制一定物质的量浓度溶液的方法和操作顺序来回答.
解答:解:(1)在电解氯化钠的电解池中,与电源负极相连的是阴极,该极区氢离子得电子产生氢气,所以碱性增强,pH增大,和电源的正极相连的是电解池的阳极,该极上是氯离子发生失电子的氧化反应,产生的是氯气,能使湿润的淀粉碘化钾试纸变蓝,可以据此检验氯气的产生,
故答案为:升高;阳;湿润的淀粉碘化钾试纸放在该极附近,试纸变蓝,证明产生的是氯气;
(2)电解饱和食盐水的产物是氢氧化钠和氢气、氯气,方程式是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)粗盐的提纯中,加氯化钡可以除去硫酸根离子,同时氯离子的进入不会引及杂质,但是加入Ba(OH)2、Ba(NO3)2 会引进氢氧根离子和硝酸根离子等杂质离子,
故答案为:C;
(4)钡试剂已经过量时,则溶液中不会再存在硫酸根离子,所以可以再向溶液中继续加氯化钡溶液,根据是否再产生白色沉淀来证明钡试剂已经过量,故答案为:静置,取上层清液继续加氯化钡溶液,如果不产生白色沉淀,则证明钡试剂已经过量;
(5)为了有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项BC符合,故答案为:BC;
(6)配制一定物质的量浓度溶液时,在移液操作中,要用玻璃棒来引流,且配置溶液的体积要和容量瓶的规格吻合,故答案为:转移液体未用玻璃棒引流,100mL的容量瓶不能配制150mL的溶液.
故答案为:升高;阳;湿润的淀粉碘化钾试纸放在该极附近,试纸变蓝,证明产生的是氯气;
(2)电解饱和食盐水的产物是氢氧化钠和氢气、氯气,方程式是:2NaCl+2H2O
| ||
| ||
(3)粗盐的提纯中,加氯化钡可以除去硫酸根离子,同时氯离子的进入不会引及杂质,但是加入Ba(OH)2、Ba(NO3)2 会引进氢氧根离子和硝酸根离子等杂质离子,
故答案为:C;
(4)钡试剂已经过量时,则溶液中不会再存在硫酸根离子,所以可以再向溶液中继续加氯化钡溶液,根据是否再产生白色沉淀来证明钡试剂已经过量,故答案为:静置,取上层清液继续加氯化钡溶液,如果不产生白色沉淀,则证明钡试剂已经过量;
(5)为了有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项BC符合,故答案为:BC;
(6)配制一定物质的量浓度溶液时,在移液操作中,要用玻璃棒来引流,且配置溶液的体积要和容量瓶的规格吻合,故答案为:转移液体未用玻璃棒引流,100mL的容量瓶不能配制150mL的溶液.
点评:本题考查学生电解池的工作原理、电解方程式的书写以及粗盐的提纯、配制一定物质的量浓度的溶液等方面的知识,属于综合知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
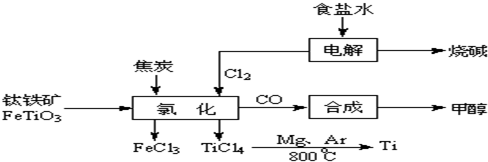
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:




 ____________
____________

 在Ar气氛中进行的理由是________
在Ar气氛中进行的理由是________