题目内容
(8分)按要求填写空白:
(1)写出醋酸钠在水中发生水解反应的离子方程式:____________。
(2)浓度均为0.1mol/L的下列4种物质的水溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
pH由大到小的顺序是_________(填数字序号)。
(3)在①H2O ②HCHO ③Cl2 ④C2H2 ⑤CCl4分子中:
全部以非极性键结合的非极性分子是_________(填数字序号,下同);
全部以极性键相结合,具有V形分子立体构型的是________;
中心原子为sp3杂化的非极性分子是_________;
中心原子为sp2杂化的极性分子是________;
既有极性键又有非极性键的非极性分子是_____________。
(1)CH3COO-+H2O CH3COOH+OH-;
CH3COOH+OH-;
(2)③④②① (3)③;①;⑤;②;④
解析试题分析:(1)醋酸钠是强碱弱酸盐,弱酸根离子水解,消耗水电离产生的H+,破坏了水的电离平衡,最终溶液中OH-的浓度大于H+的浓度,因此溶液显碱性,水解的离子方程式是:CH3COO-+H2O  CH3COOH+OH-;(2)①硫酸是二元强酸,完全电离②醋酸是一元弱酸,部分电离;④氯化铵是强酸弱碱盐,水解使溶液显酸性,由于盐的水解程度是很微弱的,③氢氧化钠是强碱,溶液中的OH-离子的浓度远远大于H+的浓度,所以当它们的浓度相等时,溶液中c(H+)由大到小的顺序是①>②>④>③,溶液的酸性越强,溶液的pH就越小,所以溶液的pH由大到小的顺序是③>④>②>① ; (3)在①H2O中,全部以极性键结合的极性分子;②在HCHO中,全部以极性键结合的极性分子;③Cl2以极性键结合的非极性分子;④C2H2以极性键、非极性键结合的非极性分子;⑤CCl4分子以极性键结合的非极性分子。所以全部以非极性键结合的非极性分子是③Cl2;全部以极性键相结合,具有V形分子立体构型的是①H2O;中心原子为sp3杂化的非极性分子是⑤CCl4分子;中心原子为sp2杂化的极性分子是②;既有极性键又有非极性键的非极性分子是④C2H2。
CH3COOH+OH-;(2)①硫酸是二元强酸,完全电离②醋酸是一元弱酸,部分电离;④氯化铵是强酸弱碱盐,水解使溶液显酸性,由于盐的水解程度是很微弱的,③氢氧化钠是强碱,溶液中的OH-离子的浓度远远大于H+的浓度,所以当它们的浓度相等时,溶液中c(H+)由大到小的顺序是①>②>④>③,溶液的酸性越强,溶液的pH就越小,所以溶液的pH由大到小的顺序是③>④>②>① ; (3)在①H2O中,全部以极性键结合的极性分子;②在HCHO中,全部以极性键结合的极性分子;③Cl2以极性键结合的非极性分子;④C2H2以极性键、非极性键结合的非极性分子;⑤CCl4分子以极性键结合的非极性分子。所以全部以非极性键结合的非极性分子是③Cl2;全部以极性键相结合,具有V形分子立体构型的是①H2O;中心原子为sp3杂化的非极性分子是⑤CCl4分子;中心原子为sp2杂化的极性分子是②;既有极性键又有非极性键的非极性分子是④C2H2。
考点:考查盐的水解、强弱电解质溶液的pH的比较、分子中原子间的化学键、分子的空间结构、原子的杂化等知识。

下列关于化学变化的叙述错误的是
| A.化学变化一定伴随能量变化 |
| B.化学变化一定有化学键的断裂和生成 |
| C.化学变化一定伴随物质的状态变化 |
| D.化学变化一定有新物质生成 |
下面有关离子化合物的说法正确是
| A.离子化合物中一定含有金属元素,含金属元素的化合物一定是离子化合物。 |
| B.离子键只存在于离子化合物中,离子化合物中一定含有离子键 |
| C.离子化合物中不可能含有共价键 |
| D.离子化合物受热融化破坏化学键,吸收能量,属于化学变化 |
下列各数值表示有关元素的原子序数,其所表示的各原子组中能以共价键相互结合成稳定化合物的是
| A.8与11 | B.9与9 | C.2与19 | D.6与8 |
已知NaCl、CsCl晶体结构中离子配位数分别为6和8,其中属于从NaCl晶体中分割出来的结构示意图是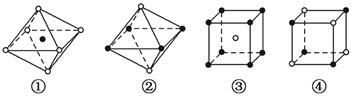
| A.①和③ | B.①和④ | C.只有③ | D.只有④ |
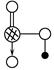 ,请简要说明该物质易溶于水的原因________________________________。
,请简要说明该物质易溶于水的原因________________________________。