题目内容
19.将48g镁条在当空气中完全燃烧,燃烧后的产物全部投入稀盐酸中,充分反应后过滤,得到的固体是C.若得到溶液的体积为2L,则所得溶液的物质的量浓度为1mol/L.如果想滤液中滴加NaOH溶液并加热,会观察到什么现象?写出有关反应的离子方程式.[已知:Mg3N2+6H2O═3Mg(OH)↓+2NH3↑]Mg2++2OH-=Mg(OH)2↓、Mg(OH)2$\frac{\underline{\;加热\;}}{\;}$MgO+H2O.分析 镁条在当空气中完全燃烧,燃烧后的产物有氧化镁、碳单质、氮化镁,固体全部投入稀盐酸中,氧化镁和盐酸反应生成氯化镁和水,根据Mg3N2+6H2O═3Mg(OH)↓+2NH3↑得到:氮化镁和盐酸反应生成氯化镁溶液,向滤液氯化镁中滴加NaOH溶液并加热,氯化镁和氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁受热分解得到氧化镁白色物质.
解答 解:镁条在当空气中完全燃烧,燃烧后的产物有氧化镁、碳单质、氮化镁,固体全部投入稀盐酸中,氧化镁和盐酸反应生成氯化镁和水,根据Mg3N2+6H2O═3Mg(OH)↓+2NH3↑得到:氮化镁和盐酸反应生成氯化镁溶液,充分反应后过滤,得到的固体是C;根据镁元素守恒,得到氯化镁的物质的量是2mol,所以所得溶液的物质的量浓度为$\frac{2mol}{2L}$=1mol/L,向滤液氯化镁中滴加NaOH溶液并加热,氯化镁和氢氧化钠反应生成氢氧化镁沉淀,Mg2++2OH-=Mg(OH)2↓,氢氧化镁受热分解得到氧化镁白色物质Mg(OH)2$\frac{\underline{\;加热\;}}{\;}$MgO+H2O,.故答案为:C;1mol/L;Mg2++2OH-=Mg(OH)2↓、Mg(OH)2$\frac{\underline{\;加热\;}}{\;}$MgO+H2O.
点评 本题考查学生金属镁的化学性质以及元素守恒知识的有关计算,难度中等,注意知识的迁移应用是关键.

练习册系列答案
相关题目
10.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个N2分子与NA个CO分子的质量比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对质量之和 | |
| C. | 在常温常压下11.2LN2含有的分子数为0.5NA | |
| D. | 1mol•L-1NaCl溶液中、含有NA个Na+ |
4.氯水中存在Cl2+H2O?H++Cl-+HClO加入下列物质,能使HClO浓度增大的是( )
| A. | NaCl | B. | NaHCO3 | C. | 浓H2SO4 | D. | Na2SO3 |
20.在某溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中( )
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42-和Ag+ | D. | 可能含有SO42-或Ag+ |


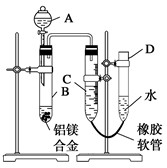 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.