题目内容
10.下列有关化学用语表示正确的是( )| A. | 氯化钙的电子式: | |
| B. | 168O2-离子的结构示意图: | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
分析 A.CaCl2是离子化合物,由钙离子与氯离子构成;
B.元素符号左下角表示质子数,左上角表示质量数,质子数+中子数=质量数,阴离子的电子数=质子数+电荷数,据此分析离子结构示意图;
C.弱电解质部分电离,用可逆号,多元弱酸分步电离,以第一步为主;
D.葡萄糖为多羟基醛,含有5个羟基一个醛基,C6H12O6为其分子式.
解答 解:A.CaCl2是离子化合物,由钙离子与氯离子构成,电子式为 ,故A正确;
,故A正确;
B.168O2-离子中的质子数是8,质量数是16,质子数+中子数=质量数,所以其中子数为10,阴离子的电子数=质子数+电荷数.所以其电子数为10,离子结构示意图为: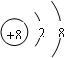 ,故B错误;
,故B错误;
C.H2CO3是弱电解质,在水溶液里不能完全电离,H2CO3是二元弱酸,必须分步电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,故C错误;
D.葡萄糖结构简式为:CH2OHCHOHCHOHCHOHCHOHCHO,故D错误;
故选A.
点评 本题考查化学用语,涉及电子式、离子的结构示意图、电离方程式、结构简式等,试题基础性强,把握化学用语的区别及规范应用为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1. (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)
据此作出的下列判断中,错误的是AB
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图( )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
Si(s)+O2(g)$\frac{\underline{\;高温\;}}{\;}$ SiO2(s),该反应的反应热△H=-990 kJ/mol
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为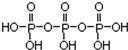 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.
 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
A、铝的化合物晶体中不存在离子晶体
B、表中只有BCl3、干冰是分子晶体
C、同族元素的氧化物可形成不同类型的晶体
D、不同族元素的氧化物可形成不同类型的晶体
(2)SiO2晶体结构片断如图(
 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.
| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
(3)与铝同周期的磷单质及其化合物有广泛应用.
①三聚磷酸可视为三个磷酸分子(磷酸结构式见图
 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.②次磷酸钠(NaH2PO2)可用于化学镀镍.NaH2PO2中P元素的化合价为+1;
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)1 Ni2++1 H2PO2-+1H2O→1 Ni+1 H2PO3-+2H+
(b)6H2PO2-+2H+=2P+4H2PO3+3H2
(4)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一镍原子,其它镍原子都在晶胞面上,该晶体的化学式是Ni5La.
18.著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献.已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应.(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2.)下列说法正确的是( )
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI $\frac{\underline{\;高温\;}}{\;}$ CeI4+2H2↑ | |
| B. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+ | |
| C. | 金属Ce保存时,应该隔绝空气和水 | |
| D. | 铈的四种核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体 |
5.下列说法正确的是( )
| A. | 能使澄清石灰水变浑浊的气体一定是CO2 | |
| B. | 能使品红溶液褪色,将其煮沸又变红的无色气体为SO2 | |
| C. | 与浓H2SO4反应可产生SO2的一定是亚硫酸的正盐 | |
| D. | 某酸性溶液经分析含大量S2-,SO42-,MnO4- |
15.下列说法不正确的是( )
| A. | 两个相邻同系物的分子量数值一定相差14 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 分子为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
2.密闭的烧瓶里盛放气体NO2,在25时建立如下平衡:2NO2?N2O4,该反应正反应为放热反应,把烧瓶置于100的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是( )
| A. | 平均相对分子质量 | B. | 混合气体的密度 | ||
| C. | 烧瓶内气体压强 | D. | 气体的物质的量 |
19.下面有关叙述正确的是( )
| A. | 13C与15N有相同的中子数 | |
| B. | 1H2O与2H2O互为同素异形体 | |
| C. | 14C与14N互为同位素 | |
| D. | CH3-CH2OH和CH3-O-CH3互为同分异构体 |