题目内容
2.将wg镁粉和铝粉的混合物溶于足量的盐酸中,再和过量的NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热灼烧,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
分析 wg镁粉和铝粉的混合物,与盐酸反应生成氯化镁和氯化铝,再与过量氢氧化钠溶液反应后得到的沉淀为氢氧化镁,将氢氧化镁加热得到的固体为MgO,取出蒸发皿中的物质称量仍为wg,根据质量守恒定律,铝粉的质量等于MgO中O元素的质量,以此计算原混合物中铝粉的质量分数.
解答 解:wgMg粉和铝粉的混合物,与盐酸反应生成氯化镁和氯化铝,再与过量氢氧化钠溶液反应后得到的沉淀为氢氧化镁,
将氢氧化镁加热得到的固体为MgO,取出蒸发皿中的物质称量仍为wg,
根据质量守恒定律,原混合物中铝粉的质量等于MgO中O元素的质量,
则原混合物中铝粉的质量分数=MgO中氧元素的质量分数=$\frac{16}{40}$×100%=40%,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,本题注意分析金属混合物反应前后物质的成分的变化,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
12.可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测正确的是( )
| A. | “类钫”属过渡元素,具有放射性 | B. | “类钫”可与水剧烈反应 | ||
| C. | “类钫”单质的密度小于1g/cm3 | D. | “类钫”单质有较高熔点 |
13.普罗帕酮是广谱高效抗心律失常的药物,它由有机物X经多步反应合成的过程如下:

下列说法正确的是( )

下列说法正确的是( )
| A. | 普罗帕酮的分子式为C19H24NO3 | |
| B. | X,Y的核磁共振氢谱图中都有4组特征峰 | |
| C. | 含少量X与Y的普罗帕酮可用烧碱溶液进行提纯 | |
| D. | 一定条件下,X、Y和普罗帕酮都能发生加成、取代、水解反应 |
10.下列比较正确的是( )
| A. | 酸性:H2CO3>H2SiO3>H3PO4 | B. | 碱性:CsOH>Ba(OH)2>Ca(OH)2 | ||
| C. | 热稳定性:H2O>HF>NH3>HCl | D. | 氧化性:Ag+<Cu2+<H+<Fe2+ |
17.对于在密闭容器中、一定条件下进行的可逆反应2SO2(g)+O2(g)?2S03(g),能说明反应已达到平衡状态的是( )
| A. | v(O2):v(SO2)=1:2 | B. | 各物质浓度相等 | ||
| C. | c(SO2)保持不变 | D. | c(SO2):c(O2):c(S03)=2:1:2 |
14.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在两升密闭容器中进行1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A. | NO 0.001 mol•L-1 | B. | H2O 0.002 mol•L-1 | ||
| C. | NH3 0.002 mol•L-1 | D. | O2 0.0025 mol•L-1 |
12.已知钍(${\;}_{90}^{232}$Th)的原子可发生下列放射性变化,${\;}_{90}^{232}$Th→${\;}_{88}^{228}$X+${\;}_{2}^{4}$α,生成的X是与钫(Fr)同周期的一种元素的原子,下列对X的推断错误的是( )
| A. | X的氢氧化物是一种强碱 | B. | X的碳酸正盐不溶于水 | ||
| C. | X原子核外有6个电子层 | D. | X的最高化合价为+2价 |
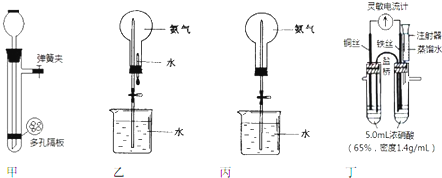

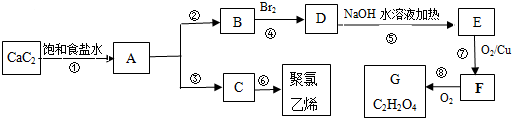
 ,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2
,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2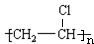 .
.