题目内容
下图转化中的字母只代表一种单质或化合物,A是淡黄色固体,B为金属单质,J是白色胶状沉淀,常温下X是液体,C、D、Y均为气体。请回答下列问题:
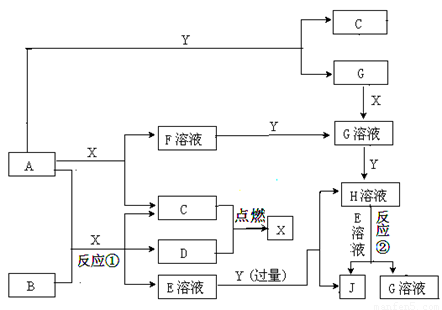
(1)写出化学式: B X
(2)A中存在的化学键类型 H的俗名 Y的电子式
(3)写出下列方程式
反应①的化学方程式
反应②的离子方程式
(14分)
(1) Al (1分)、 H2O (1分)
(2)离子键和共价键(或非极性键)(2分);小苏打(2分)
; 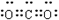 (2分)
(2分)
(3)反应①2Al+Na2O2+3H2O=2NaAlO2+O2↑+3H2↑(3分)
反应②AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-(3分)
【解析】
试题分析:(1)突破口:A是淡黄色固体,由转化关系可知A:Na2O2,X是液体,X:H2O、B为金属单质,
B+ H2O+ Na2O2反应 与碱反应的金属 B:Al。
A+X→F溶液+C, F:NaOH C:O2、
A+Y→G+C Y为气体,Y:CO2、G :Na2CO3
C+D→X D:H2、
B+ H2O+ Na2O2→C+D+E溶液 E:NaAlO2
E+Y(过)→H+J,J是白色胶状沉淀,J:Al(OH)3
G加X变成Na2CO3溶液 (G溶液)。G+Y→H H:NaH CO3
①B+A+X=C+D+E溶液 Al+Na2O2+ H2O→O2+ H2+ NaOH
②H+E→G+J H2O + NaH CO3+ NaAlO2→Na2CO3 + Al(OH)3↓
所以:A:Na2O2 B:Al C:O2 D:H2 E:NaAlO2 F:NaOH G :Na2CO3 H:NaH CO3 J:Al(OH)3
Y:CO2 X:H2O
考点:本题以元素推断为基础,考查铝及其化合物的性质等知识。

 阅读快车系列答案
阅读快车系列答案

 的反应中,被氧化与被还原的物质的物质的量比是 。
的反应中,被氧化与被还原的物质的物质的量比是 。 的离子方程式是 。
的离子方程式是 。 受热分解的化学方程式是 。
受热分解的化学方程式是 。
 受热分解的化学方程式是 。
受热分解的化学方程式是 。