题目内容
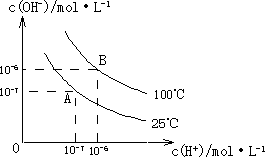
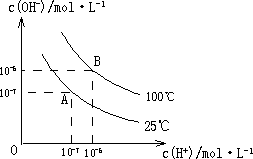
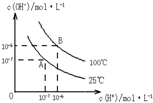 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:(1)A点水的离子积为1×10-14,B点水的离子积为
造成水的离子积变化的原因是
(2)100℃时,0.01mol/LNaOH溶液的c(OH-)=
(3)25℃时,将pH=13的NaOH溶液与pH=2的稀盐酸混合,欲使混合溶液的pH=7,则NaOH溶液与盐酸的体积比为
分析:(1)c(H+).c(OH-)=Kw,水的电离是吸热反应,升高温度促进电离;
(2)100℃时,0.01mol/LNaOH溶液的c(OH-)=0.01mol/L,(H+)=
,pH=-lgc(H+);
(3)25℃时,pH=13的NaOH溶液中c(OH-)=0.1mol/L、pH=2的稀盐酸溶液中(H+)=0.01mol/L,二者混合时溶液的pH=7,溶液呈中性,则酸的物质的量等于碱的物质的量,据此计算二者体积之比.
(2)100℃时,0.01mol/LNaOH溶液的c(OH-)=0.01mol/L,(H+)=
| Kw |
| C(OH-) |
(3)25℃时,pH=13的NaOH溶液中c(OH-)=0.1mol/L、pH=2的稀盐酸溶液中(H+)=0.01mol/L,二者混合时溶液的pH=7,溶液呈中性,则酸的物质的量等于碱的物质的量,据此计算二者体积之比.
解答:解:(1)c(H+).c(OH-)=Kw=10-6×10-6=10-12,水的电离是吸热反应,升高温度促进电离,导致其离子积常数增大,故答案为:10-12;水的电离是吸热反应,升高温度促进电离,所以水的离子积常数增大;
(2)100℃时,0.01mol/LNaOH溶液的c(OH-)=0.01mol/L,(H+)=
=
mol/L=10-10 mol/L,pH=-lgc(H+)=10,故答案为:0.01mol/L;10;
(3)25℃时,pH=13的NaOH溶液中c(OH-)=0.1mol/L、pH=2的稀盐酸溶液中(H+)=0.01mol/L,二者混合时溶液的pH=7,溶液呈中性,则酸的物质的量等于碱的物质的量,设NaOH的体积为x,HCl的体积为y,所以0.1x=0.01y,则x:y=1:10,故答案为:1:10.
(2)100℃时,0.01mol/LNaOH溶液的c(OH-)=0.01mol/L,(H+)=
| Kw |
| C(OH-) |
| 10-12 |
| 0.01 |
(3)25℃时,pH=13的NaOH溶液中c(OH-)=0.1mol/L、pH=2的稀盐酸溶液中(H+)=0.01mol/L,二者混合时溶液的pH=7,溶液呈中性,则酸的物质的量等于碱的物质的量,设NaOH的体积为x,HCl的体积为y,所以0.1x=0.01y,则x:y=1:10,故答案为:1:10.
点评:本题考查了pH的简单计算,根据离子积常数公式、pH值公式进行分析解答即可,注意(2)题中离子积常数不是10-14,为易错点.

练习册系列答案
相关题目