题目内容
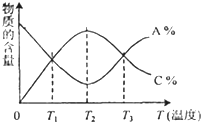 已知可逆反应aA+bB?cC中,物质的含量A%和C%随时间进行、温度的变化曲线如图所示,下列说法正确的是( )
已知可逆反应aA+bB?cC中,物质的含量A%和C%随时间进行、温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1温度时已达到过化学平衡 | B、该反应在T3温度时才达到过化学平衡 | C、增大压强平衡一定会向正反应方向移动 | D、该可逆反应的正反应是放热反应 |
分析:T2℃之前A%变小,C%从0逐渐增大,而T2℃之后A%渐大,C%渐小,说明T2℃之前该反应未达到平衡状态,而T2℃时为化学平衡状态,T2℃之后是温度升高使平衡向左移动,所以逆反应是吸热反应,正反应为放热反应,据此分析.
解答:解:A.该反应在T1温度后T2℃前,A%仍然变小,C%仍然增大,说明该反应未达到平衡状态,故A错误;
B.T2℃前A%、C%都变化,说明没有达到平衡状态,在T2℃后A%、C%都变化,说明T2℃时达到过化学平衡,故B错误;
C.该图象只描述反应与温度的关系,无法判断与压强关系,故C错误;
D.在T2℃后升高温度,反应物含量增大、生成物含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,故D正确;
故选D.
B.T2℃前A%、C%都变化,说明没有达到平衡状态,在T2℃后A%、C%都变化,说明T2℃时达到过化学平衡,故B错误;
C.该图象只描述反应与温度的关系,无法判断与压强关系,故C错误;
D.在T2℃后升高温度,反应物含量增大、生成物含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,故D正确;
故选D.
点评:本题化学反应图象分析,明确图象中曲线变化趋势与温度的关系是解本题关键,会根据图象确定平衡状态及反应热,题目难度不大.

练习册系列答案
相关题目
 已知可逆反应aA+bB?cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
已知可逆反应aA+bB?cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A、该反应在T1、T3温度时达到过化学平衡 | B、该反应在T2温度时达到化学平衡 | C、升高温度,平衡会向正反应方向移动 | D、该反应的正反应是放热反应 |
 cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是(
)
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是(
)

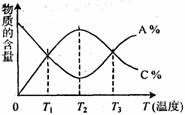 A.该反应在T1、T3温度时达到化学平衡
A.该反应在T1、T3温度时达到化学平衡